网址:http://m.1010jiajiao.com/timu_id_169998[举报]
16.(1)水 浓硫酸 ;(2)检查气密性,将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好;
(3)先从A瓶逐滴滴加液体, 检验H2的纯度;(4) ,
,  。
。
17.(1) 2Fe3++H2S
= S↓+2Fe2++2H+, Na2S+2H2O S↓+H2↑+2NaOH
S↓+H2↑+2NaOH
或S2-+2H2O S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
(2)阳离子(Na+),钛(或石墨);
(3)4, 正四面体。
18.(1)Al(OH)3+OH---=AlO2-+2H2O ; (2) ;
;
(3)SO2+Cl2+2H2O=H2SO4+2HCl ; (4)HCl>H2S;
(5)S2->Cl ->Na+>Al3+;(6)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol。
19. (1) ①SiHCl3+H2= Si+3HClwww. Ks5 u.com
②3SiHCl3+3H2O===H2SiO3+H2↑+3HCl;高温下,H2遇O2发生爆炸。(2)ABCE
(3)生成白色絮状沉淀,又刺激性气味的气体生成。
20.
(1)NaCl; (2)Cu+2H2SO4 CuSO4+ SO2↑+2H2O,高温、催化剂; (3)CH3CH2OH。
CuSO4+ SO2↑+2H2O,高温、催化剂; (3)CH3CH2OH。
21. ⑴b ; ⑵加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2,若溶液不变红,则原通入气体是O3 ; ⑶2Fe+3Cl2 2FeCl3 Fe+S
2FeCl3 Fe+S FeS(其他合理答案均给分);
FeS(其他合理答案均给分);
⑷①H-C≡N ; ⑸16w1:(44w2-aw1)。
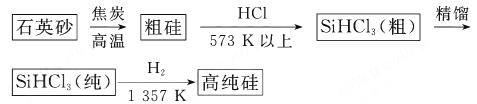
(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式
| ||
| ||
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式
(2)下列有关硅材料的说法正确的是
A.碳化硅化学性质稳定,可用于生产耐高温水混
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.普通玻璃是由纯碱、石灰石和石英砂的,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象并给予解释
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。
三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;
H2还原SiHCl3过程中若混入O2,可能引起的后果是
。
(2)下列有关硅材料的说法正确的是 (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
高温 查看习题详情和答案>>
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混入O2,可能引起的后果是 。
(2)下列有关硅材料的说法正确的是 (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
查看习题详情和答案>>(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷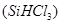 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯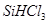 制备高纯硅的化学方程式: 。
制备高纯硅的化学方程式: 。
②整个制备过程必须严格控制无水无氧。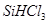 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和另一种物质,配平后的化学反应方程式为? ;
、HCl和另一种物质,配平后的化学反应方程式为? ;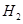 还原
还原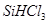 过程中若混入
过程中若混入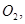 可能引起的后果是? 。
可能引起的后果是? 。
(2)下列有关硅材料的说法正确的是? (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,振荡。写出实验现象并给予解释 。
查看习题详情和答案>>
(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷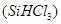 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 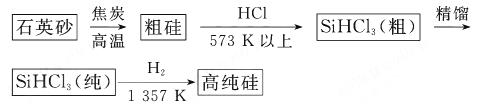
①写出由纯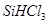 制备高纯硅的化学方程式: 。
制备高纯硅的化学方程式: 。
②整个制备过程必须严格控制无水无氧。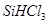 遇水剧烈反应生成
遇水剧烈反应生成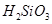 、HCl和另一种物质,配平后的化学反应方程式为? ;
、HCl和另一种物质,配平后的化学反应方程式为? ;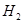 还原
还原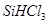 过程中若混入
过程中若混入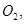 可能引起的后果是? 。
可能引起的后果是? 。
(2)下列有关硅材料的说法正确的是? (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,振荡。写出实验现象并给予解释 。 查看习题详情和答案>>