网址:http://m.1010jiajiao.com/timu_id_169056[举报]
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
A
C
D
B
D
D
A
C
A
AD
A
C
BD
D
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共18分)
15.(12分)(1)过滤(2分) 蒸发、结晶(2分) (2)从漏斗向量气筒内注入一定量的水,连接好装置,移动漏斗形成液面高度差,静置后,液面高度不再变化,即表明气密性良好。(其他合理方法均给分)(2分)
(3)移动漏斗保持液面与量气筒液面相平,防止试管和量气筒内气体压强过大 (4分,各2分)
(4) %(2分)
%(2分)
16.(6分,各2分)(2)向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色复出,则是因为HCl和HClO的酸性所致,甲正确;若红色不再复出,则是因为HClO的强氧化性所致,乙正确。
(3)在试管中注入滴有酚酞的氨水,加热试管,观察溶液颜色变化,如果颜色变浅,则加热使氨水中的c(OH一)减小,乙正确;如颜色变深,则加热使氨水中的c(OH一)增大,甲正确。
(4)向Mg(OH)2沉淀中加入中性的醋酸铵浓溶液,加入后若Mg(OH)2不溶解,甲正确;加入后若Mg(OH)2溶解,则乙正确。
四、(本题包括2小题,共22分)
17.(12分,每空2分)(1)
(2)减小 , OH―中和了反应中的H+,有利于平衡向右进行,提高CuCl的产率。但当OH―浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降减了CuCl的产率。
注此答案同题目不一致
(3)
(4)反应①在隔绝空气条件下进行。
18.(10分,每空2分)
(1)6(NH2)2CO → C3H6N6 + 6NH3 + 3CO2、4NO2 + O2+2H2O = 4HNO3、 CO2+4H2→CH4 +2H2O
(2)66.7% (3)做耐磨材料等。
五、(本题包括1小题,共12分)
19.(12分)
(1)Fe-6e-+8OH-ㄔFeO42-+4H2O(2分)
(2)铁丝网的接触面积更大。(2分)因为铁电极上发生析氧反应4OH--4e-ㄔO2↑+2H2O,氧气将铁氧化而得到氧化铁膜。(也可以直接写电极反应式或综合式:6OH--6e-+2FeㄔFe2O3+3H2O)(2分)
(3)ACD(2分,对1―2个给1分,全对得2分,错1个扣1分)
(4)升温电解一方面加快了高铁酸盐的生成速率,另一方面又加速FeO42-的分解,10~
(5)BCD(2分,对1―2个给1分,全对得2分,错1个扣1分)
六、(本题包括1小题,共10分)
20.(10分)(1)BD (2分,对1个得1分,多选1个扣1分,扣完为止) (2)小于,减小 (2分)
(3)不,1.0(4分,各2分) (4)56(2分)
七、(本题包括1小题,共10分)
21.(10分)(1)2Cl―+2H2O=2OH―+Cl2↑+H2↑(2分)
(2)A(2分)
(3)n(H2)= n(已电解NaCl)=500
mol´2=1000
mol(1分)
n(已电解NaCl)=500
mol´2=1000
mol(1分)
n(总NaCl)=1000
/0.9 mol m(总NaCl)=
1000 /0.9 mol´
m(NaCl溶液)=
(4)由n(H2)=500 mol得:n(CH4)= 500 mol´2/8=125 mol(2分)
V(CH4)= 125 mol ´
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节碱式滴定管液面至0或0刻度以下,记下读数
(F)锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
(2)上述(B)操作的目的是
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是
(4)实验中用一手控制
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是
(6)滴在锥形瓶内壁上的KOH用蒸馏水冲下,则对滴定结果的影响是
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节碱式滴定管液面至0或0刻度以下,记下读数
(F)锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写) .
(2)上述(B)操作的目的是 .
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是 (填偏大、偏小、不变,下同).
(4)实验中用一手控制 (填仪器及部位),另一手摇动锥形瓶,眼睛注视 ,直至滴定终点.判断到达终点的现象是 .
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是 .
(6)滴在锥形瓶内壁上的KOH用蒸馏水冲下,则对滴定结果的影响是 . 查看习题详情和答案>>
某学生用0.1000 mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)________.
(2)上述(B)操作的目的是________.
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)________.
(4)实验中用左手控制________(填仪器及部位),眼睛注视________,直至滴定终点.判断到达终点的现象是________.
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是________.
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是________.
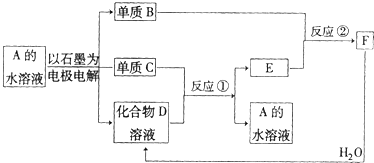
(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液.则C.E.F的化学式分别是
| ||
| ||
(2)若反应①和②需要在一定条件才能进行,则电解A溶液的两极反应式分别为
| ||
| ||
当有1mol电子转移时,标况下生成
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是____________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。