网址:http://m.1010jiajiao.com/timu_id_159100[举报]
1.D 2.D 3.B 4.D 5.D 6.B 7.A 8.C
9.C 10.AB 11.D 12.C 13.C 14.C
15.(1)检验反应中生成的H2 (2分)
(2)Fe Fe3O4溶于盐酸生成的Fe3+ 与Fe反应生成了Fe2+ (2分)
(3)① 2Fe2++2H++H2O2=2Fe3++2H2O (2分)
②取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,表明沉淀已洗涤干净 (2分)
③固体样品质量和红褐色固体的质量 (2分)
(本题共10分,其它合理答案参照给分)
 (3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(4)CaO、H2O 或Ca(OH)2
(5) 原子利用率高,没有有害物质排放到环境中 (每空2分,共10分)
19.(1)  (2)酸性KMnO4溶液 (3) 3
(2)酸性KMnO4溶液 (3) 3
(4) 
 |
(5)
(6) 
 (每空2分,共12分)
(每空2分,共12分)
20.(1) (C6H10O5)n+nH2O 3nCH4↑+3nCO2↑ (2分)
(2)9.20 (
(3) 设反应③中消耗O2的物质的量为x,则N2的物质的量为4x
2CH4+O2→4H2+2CO CH4 + H2O → 3H2 + CO
2x x 4x 2x 1×103-2x (1×103-2x)×3 (1×103-2x)
合成二甲醚反应中CO和H2为1∶2,合成氨反应中,N2与H2体积比为1∶3,则
4x+(1×103-2x)×3-[2x+(1×103-2x)]×2=4x×3 (3分,关系式)
x=1000/14 mol
NH3
:4x×2×17=
答略。(本题共10分,其它合理答案参照给分)
21.(1) 1s22s22p63s23p63d54s2 (2分)
Mn2+的3d轨道电子排布为半满状态较稳定 (2分)
(2) 直线型 (2分) CO2 (2分)
(3) 1:2 (1分)  (1分) 30 (2分)
(1分) 30 (2分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
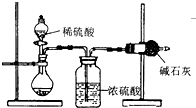 测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:
测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:I.吸收法
如图所示:
(1)根据实验装置图分析,在每次实验过程中所进行的称量操作至少要进行
(2)若重复测定了三次,得到Na2CO3的质量分数的数据存在较大的偏差,产生偏差的原因可能是
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.用了稀硫酸与样品反应
C.加入稀硫酸的量不足,则可能造成误差
D.反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收
除上述原因外,从装置看还有一个重要原因是
II.滴定法
称取样品m g,配制成500mL溶液.从中取出25mL加入足量的BaCl2溶液振荡,滴加2~3滴酚酞,用a mol/L标准盐酸滴定,至终点时消耗盐酸v mL.
(1)该同学加入足量的BaCl2溶液后未将BaCO3过滤就滴定,有人认为在滴定中BaCO3会转化为Ba(HCO3)2,消耗盐酸.你认为要过滤吗?
(2)判断滴定终点到达的依据是
Ⅲ.沉淀法
称取样品m g,并溶解加过量Ba(NO3)2溶液,过滤、洗涤、烘干,称量得固体n g.
(1)混合物中碳酸钠的质量分数为(用m、n表示)
| 106n |
| 197m |
| 106n |
| 197m |
(2)洗涤沉淀的操作要点是
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用Ba(NO3)2溶液而不用Ca(NO3)2溶液的原因是
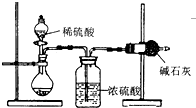 测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:
测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:
I.吸收法
如图所示:
(1)根据实验装置图分析,在每次实验过程中所进行的称量操作至少要进行______次,且第一次称量操作的对象是______.
(2)若重复测定了三次,得到Na2CO3的质量分数的数据存在较大的偏差,产生偏差的原因可能是______(填序号).
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.用了稀硫酸与样品反应
C.加入稀硫酸的量不足,则可能造成误差
D.反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收
除上述原因外,从装置看还有一个重要原因是______.
II.滴定法
称取样品m g,配制成500mL溶液.从中取出25mL加入足量的BaCl2溶液振荡,滴加2~3滴酚酞,用a mol/L标准盐酸滴定,至终点时消耗盐酸v mL.
(1)该同学加入足量的BaCl2溶液后未将BaCO3过滤就滴定,有人认为在滴定中BaCO3会转化为Ba(HCO3)2,消耗盐酸.你认为要过滤吗?______(填“是”或“否”),理由是:______(若填“是”,不需答).
(2)判断滴定终点到达的依据是______.
Ⅲ.沉淀法
称取样品m g,并溶解加过量Ba(NO3)2溶液,过滤、洗涤、烘干,称量得固体n g.
(1)混合物中碳酸钠的质量分数为(用m、n表示)______.
(2)洗涤沉淀的操作要点是______.
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用Ba(NO3)2溶液而不用Ca(NO3)2溶液的原因是______;测定CO32-的量,若使用Ba(OH)2溶液而不用Ca(OH)2溶液,结果将具有更高的精确度,原因______.
查看习题详情和答案>>
I.吸收法
如图所示:
(1)根据实验装置图分析,在每次实验过程中所进行的称量操作至少要进行______次,且第一次称量操作的对象是______.
(2)若重复测定了三次,得到Na2CO3的质量分数的数据存在较大的偏差,产生偏差的原因可能是______(填序号).
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.用了稀硫酸与样品反应
C.加入稀硫酸的量不足,则可能造成误差
D.反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收
除上述原因外,从装置看还有一个重要原因是______.
II.滴定法
称取样品m g,配制成500mL溶液.从中取出25mL加入足量的BaCl2溶液振荡,滴加2~3滴酚酞,用a mol/L标准盐酸滴定,至终点时消耗盐酸v mL.
(1)该同学加入足量的BaCl2溶液后未将BaCO3过滤就滴定,有人认为在滴定中BaCO3会转化为Ba(HCO3)2,消耗盐酸.你认为要过滤吗?______(填“是”或“否”),理由是:______(若填“是”,不需答).
(2)判断滴定终点到达的依据是______.
Ⅲ.沉淀法
称取样品m g,并溶解加过量Ba(NO3)2溶液,过滤、洗涤、烘干,称量得固体n g.
(1)混合物中碳酸钠的质量分数为(用m、n表示)______.
(2)洗涤沉淀的操作要点是______.
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用Ba(NO3)2溶液而不用Ca(NO3)2溶液的原因是______;测定CO32-的量,若使用Ba(OH)2溶液而不用Ca(OH)2溶液,结果将具有更高的精确度,原因______.
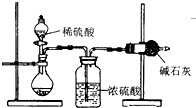
I.吸收法
如图所示:
(1)根据实验装置图分析,在每次实验过程中所进行的称量操作至少要进行______次,且第一次称量操作的对象是______.
(2)若重复测定了三次,得到Na2CO3的质量分数的数据存在较大的偏差,产生偏差的原因可能是______(填序号).
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.用了稀硫酸与样品反应
C.加入稀硫酸的量不足,则可能造成误差
D.反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收
除上述原因外,从装置看还有一个重要原因是______.
II.滴定法
称取样品m g,配制成500mL溶液.从中取出25mL加入足量的BaCl2溶液振荡,滴加2~3滴酚酞,用a mol/L标准盐酸滴定,至终点时消耗盐酸v mL.
(1)该同学加入足量的BaCl2溶液后未将BaCO3过滤就滴定,有人认为在滴定中BaCO3会转化为Ba(HCO3)2,消耗盐酸.你认为要过滤吗?______(填“是”或“否”),理由是:______(若填“是”,不需答).
(2)判断滴定终点到达的依据是______.
Ⅲ.沉淀法
称取样品m g,并溶解加过量Ba(NO3)2溶液,过滤、洗涤、烘干,称量得固体n g.
(1)混合物中碳酸钠的质量分数为(用m、n表示)______.
(2)洗涤沉淀的操作要点是______.
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用Ba(NO3)2溶液而不用Ca(NO3)2溶液的原因是______;测定CO32-的量,若使用Ba(OH)2溶液而不用Ca(OH)2溶液,结果将具有更高的精确度,原因______.
 查看习题详情和答案>>
查看习题详情和答案>>
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究.
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有
(2)探究分解得到的固体产物中铁元素的存在形式.
①提出假设
假设1:
②设计实验方案证明假设3.
限选试剂:1.0mol?L-1盐酸、3% H2O2、0.1mol?L-1CuSO4、20% KSCN、蒸馏水.
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 |
若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中,滴加 |
①将准确称量的0.20g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红.将滤液过滤至另一个锥形瓶中,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL
③重复以上实验1~2次
若某小组的一次测定数据记录如下:V1=18.90mL,V2=6.20mL.根据数据计算0.20g 样品中:n(Fe2+)=