网址:http://m.1010jiajiao.com/timu_id_153220[举报]
第一部分 选择题 (共63分)
1
2
3
4
5
6
7
8
9
B
C
D
D
C
B
A
A
C
10
11
12
13
14
15
16
17
18
C
AD
B
C
B
C
AC
BD
AD
第二部分 非选择题 (共87分)
19.(10分)(1)Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓(2分)
(2)NH3、CO2 (2分) 不需要(2分)
(3)Mn2+(2分) 450(2分)
20.(12分) (l)假设2 :溶液中存在SO32―和HCO3―( 1分)
假设3、溶液中存在HCO3―和SO42―(2和3顺序不限。)(1分)
(2)(10分)
步骤编号
实验操作
预期现象和结论
①
用胶头滴管取少量溶液加入试管A中,再用滴管取过量的lmol/L氯化钡溶液并滴入其中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管B,C中(3分)
产生白色沉淀,说明原溶液中含有SO42―或SO32―或两者都有(1分)
②
往装有沉淀的试管B中加入过量的2mol/L盐酸,
将产生的气体通入品红溶液(2分)
沉淀部分溶解, 并产生气体.
品红褪色,说明原溶液中一定含有SO42―和SO32―(1分)
③
往装有滤液的试管C中加入2mol/L盐酸;
或加入澄清石灰水(2分)
出现无色气泡,
澄清溶液变浑浊,说明原溶液中含有HCO3―(1分)
④
其它方案合理给分
21(12分)(1)SO2+NaOH=NaHSO3 (1分) HSO3-+H+==SO2+H2O (1分)
(2) AB (2分) 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量 (2分)
(3)变废为肥,充分利用资源,降低污染 (2分)
(4)+4 (2分)
(5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O (2分)
22.(10分)⑴MgCl2(熔融)  Mg+Cl2↑
(2分) ⑵Na2S (1分)
Mg+Cl2↑
(2分) ⑵Na2S (1分)
⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH- (2分)
H2CO3 +OH- (2分)
②降低含硫烟气的温度(或减小含硫烟气的流速)(2分)
③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42- (2分)
中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(1分)
23.(12分)
⑴.氢氧化钠(或氢氧化钾) (1分)
SO2+2OH?=SO32-+H2O (2分)
2SO32-+O2=2SO42? (2分)
⑵.使SO32-完全氧化为SO42? (2分)
⑶. (或其它合理答案) (2分)
(或其它合理答案) (2分)
⑷.250 mL容量瓶 (1分)
⑸.不合理,会使所测得的铁元素的质量分数偏大(或其它合理答案)(2分)
24.(12分)(1)错误!不能通过编辑域代码创建对象。 (2分)
 (2)9.52 %
(2分)
(2)9.52 %
(2分)
(3)如图所示[注:只要起点在横坐标轴(0,2),
平衡点在横坐标0点后t0前、纵坐标0.2处的示意
图均给分)(4分)
(4)减小 (2分)>(2分)
 25(9分)
25(9分)

26.(1)羟基 羧基 (2分)
错误!不能通过编辑域代码创建对象。 (2分)
(2)
错误!不能通过编辑域代码创建对象。(2分)
(3)A C D (2分)
(4) 错误!不能通过编辑域代码创建对象。 错误!不能通过编辑域代码创建对象。 (2分)
27.⑴分子 (1分) 1s2s22p63s23p63d84s2或[Ar]3d84s2 (2分)
⑵ACD (2分)
⑶①、③、④ (2分)平面三角 (1分)
⑷LaNi5或Ni5La (2分)
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+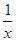 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+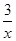 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
则CO与Sx生成COS反应的热化学方程式是________________________。
(2)有人设想按如图所示装置用废气中的SO2生产硫酸。
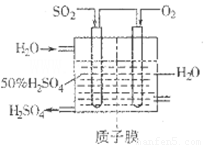
写出SO2电极的电极反应式__________________________。
(3)提高反应2SO2(g)+O2(g)
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5 min后反应达到平衡,二氧化硫的转化率为50%,前5 min内SO2的平均反应速率为___________。
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是
_________(填序号)。
a.温度和容器体积不变,充入1.0molHe (g)
b.温度和容器体积不变,充入2molSO2和lmolO2
c.温度和容器体积不变,充入1.0molSO2
d.在其他条件不变时,减小容器的容积
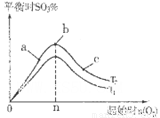
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)
 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
查看习题详情和答案>>
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收。
① 上述流程中,可循环利用的物质:
② 写出步骤(III)反应的离子方程式:
⑵某实验小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。
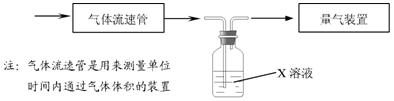
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
(3) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+![]() Sx 、
Sx 、
CO+![]() Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+![]() Sx 。其中COS的电子式 。
Sx 。其中COS的电子式 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看习题详情和答案>>(10分)近年
来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收。
① 上述流程中,可循环利用的物质:
② 写出步骤(III)反应的离子方程式:
⑵某实验小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。
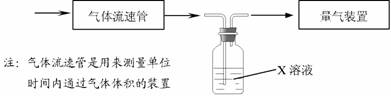
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
(3) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+![]() Sx 、
Sx 、
CO+![]() Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+![]() Sx 。其中COS的电子式 。
Sx 。其中COS的电子式 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看习题详情和答案>>国家环保总局“2006年环境监测公报”指出,减少SO2的排放和生活废水的处理是我国“十一五”期间环境保护的主要任务。
请回答下列问题:
⑴ SO2的排放是造成酸雨的主要因素。某地区酸雨pH随时间的变化如右图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因 。
⑵ 新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
⑶ 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+![]() Sx 、CO+
Sx 、CO+![]() Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+![]() Sx 。其中COS分子的空间构型为 。
Sx 。其中COS分子的空间构型为 。
⑷ 生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看习题详情和答案>>(10分).近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-)
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+Sx 、
CO+Sx=COS、2COS+SO2=2CO2+
Sx 。其中COS中“C”化合价为 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看习题详情和答案>>