网址:http://m.1010jiajiao.com/timu_id_144044[举报]
9.C 10.B 11.A 12.A 13.D 14.D 15.C
28 (13分)
(1) HNO3 NH3 .files/image024.gif) H2O NH4NO3 (3分)
H2O NH4NO3 (3分)
(2)2Al+2OH- +6H2O=====2[Al(OH)4]- +3H2 Ó 或2Al+2OH- +2H2O====2AlO2- +3H2Ó(2分);
(3)I.<(2分) II K1/K2;66.67%(4分)
(4)N2+8H+ +6e- =======2NH4+(2分)
29.(15分)
(1)①NaNO2(2分);0.8(2分 ) ②b、c(2分 )
(2)①Fe3+>Cu2++>Fe2+(2分)
②方案:将铜棒与碳棒用导线连接,再插入氯化铁溶液,发现有电流产生(3分)
(3)①Cu2+、Fe2+(2分)
②1.0.files/image026.gif) 10-17(mol
10-17(mol.files/image024.gif) L-1)3(2分)
L-1)3(2分)
30(14分)
(1) C(2分)
(2) 避免 Na2SO3==== Na2S+ 2 Na2SO4(2分)
(3)
4 Na2SO3.files/image029.gif) 3
Na2SO4(2分)
3
Na2SO4(2分)
(4)
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO2-3,的溶液的碱性强,pH增大(2分);S2-+H2O.files/image009.gif) HS-+HO-(2分)
HS-+HO-(2分)
(5)
取 ③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-(或向其中加新制氯水,如有浑浊出现,则证明有S2-)(2分),另取③中溶液适量于试管中,加入HCL酸化的BaCL2溶液,如有白色沉淀 证明SO2-4.files/image031.gif) 38(8分)
38(8分)
31.(8分)
(1) 苯环,醛基(1分);
(2) D(1分)
(3)
.files/image032.gif)
(4)4分(2分)
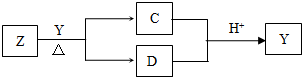 Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
I、写出Y与Z反应的离子方程式:______.
II、某同学在精确测试D溶液的pH操作时,遇到了困惑.
[实验操作]
①准确称取纯净的Na2SO3?7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②再次准确称取25.20g上述晶体,继而隔绝空气600℃以上高温下强热至恒重.
③将②所得12.60g固体进行分析,组成与D无异.将其溶于水测得pH=10.3.
[查阅资料]
①H2S的电离常数(25℃) K1=1.3×10-7 K2=7.1×10-15
②H2SO3的电离常数(25℃) K1=1.3×10-2 K2=6.2×10-8
[分析猜想]D?7H2O在强热下失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)判断实验操作②中隔绝空气强热至“恒重”的依据______.
(2)猜想D在高温强热下发生分解反应的化学方程式是______.
(3)实验操作①和③中,两次测得的溶液pH相差明显,其合理的解释是______.
(4)请你设计简单的实验方案,验证猜想的正确性.简单叙述实验步骤、现象和结论.______.
查看习题详情和答案>>
| S2O | 2- 3 |
| S4O | 2- 6 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是
| ||
| ||
(3)某学习小组用“间接碘量法”测定含有CuCl2?2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2?2H2O的质量百分数为
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是
(3)某学习小组用“间接碘量法”测定含有CuCl2?2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI).用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(所发生的离子反应:I2+2S2O32-═2I-+S4O62-).
①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2?2H2O的纯度为
| O | 2- 3 |
| O | 2- 6 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是Cu2+发生水解反应.由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是
(3)某学习小组用“间接碘量法”测定含有CuCl2?2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成CuI(2Cu2++4I-=2CuI↓+I2)白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用
②该试样中CuCl2?2H2O的质量百分数为