题目内容
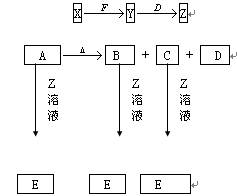
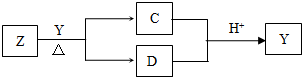 Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
I、写出Y与Z反应的离子方程式:______.
II、某同学在精确测试D溶液的pH操作时,遇到了困惑.
[实验操作]
①准确称取纯净的Na2SO3?7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②再次准确称取25.20g上述晶体,继而隔绝空气600℃以上高温下强热至恒重.
③将②所得12.60g固体进行分析,组成与D无异.将其溶于水测得pH=10.3.
[查阅资料]
①H2S的电离常数(25℃) K1=1.3×10-7 K2=7.1×10-15
②H2SO3的电离常数(25℃) K1=1.3×10-2 K2=6.2×10-8
[分析猜想]D?7H2O在强热下失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)判断实验操作②中隔绝空气强热至“恒重”的依据______.
(2)猜想D在高温强热下发生分解反应的化学方程式是______.
(3)实验操作①和③中,两次测得的溶液pH相差明显,其合理的解释是______.
(4)请你设计简单的实验方案,验证猜想的正确性.简单叙述实验步骤、现象和结论.______.
解:Y为短周期淡黄色固体单质,应为S,Z为NaOH,C为Na2S,D为Na2SO3,则
I.S在碱性条件下自身发生氧化还原反应,反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O,
故答案为:3S+6OH-=2S2-+SO32-+3H2O;
II.(1)将固体加热至恒重,固体的质量不变,可两次称量固体的质量,判断是否不变,具体做法是隔绝空气600以上高温下强热,放入干燥器中冷却至室温后称量,重复该操作,直至两次称量结果保持不变,
故答案为:隔绝空气600以上高温下强热,放入干燥器中冷却至室温后称量,重复该操作,直至两次称量结果保持不变;
(2)Na2SO3在高温条件下自身发生氧化还原反应:4Na2SO3 Na2S+3Na2SO4,
Na2S+3Na2SO4,
故答案为:4Na2SO3 Na2S+3Na2SO4;
Na2S+3Na2SO4;
(3)由于酸性:H2SO3>H2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强,
故答案为:实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强;
(4)Na2SO3在高温条件下自身发生氧化还原反应生成Na2S和Na2SO4,可取固体配成溶液,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-,另取溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-.
故答案为:取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-;另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-.
分析:Y为短周期淡黄色固体单质,应为S,Z是一种化合物,焰色反应呈黄色,应含有Na元素,0.1mol?L-1Z的水溶液pH=13,说明为一元强碱,则Z为NaOH,二者发生:3S+6OH-=2S2-+SO32-+3H2O,则C、Y、D都含同一种元素,且此元素化合价依次升高,则C为Na2S,D为Na2SO3,在酸性条件下发生反应:2S2-+SO32-+6H+=2S↓+3H2O,由于酸性:H2SO3>H2S,相同条件下,S2-水解程度大于SO32-,在高温条件下自身发生氧化还原反应:4Na2SO3 Na2S+3Na2SO4,以此解答该题.
Na2S+3Na2SO4,以此解答该题.
点评:本题考查无机物的推断和物质的组成探究,题目难度中等,本题注意把握S的单质及其化合物的性质,注意根据物质的性质选择实验方案.
I.S在碱性条件下自身发生氧化还原反应,反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O,
故答案为:3S+6OH-=2S2-+SO32-+3H2O;
II.(1)将固体加热至恒重,固体的质量不变,可两次称量固体的质量,判断是否不变,具体做法是隔绝空气600以上高温下强热,放入干燥器中冷却至室温后称量,重复该操作,直至两次称量结果保持不变,
故答案为:隔绝空气600以上高温下强热,放入干燥器中冷却至室温后称量,重复该操作,直至两次称量结果保持不变;
(2)Na2SO3在高温条件下自身发生氧化还原反应:4Na2SO3
 Na2S+3Na2SO4,
Na2S+3Na2SO4,故答案为:4Na2SO3
 Na2S+3Na2SO4;
Na2S+3Na2SO4;(3)由于酸性:H2SO3>H2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强,
故答案为:实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强;
(4)Na2SO3在高温条件下自身发生氧化还原反应生成Na2S和Na2SO4,可取固体配成溶液,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-,另取溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-.
故答案为:取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-;另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-.
分析:Y为短周期淡黄色固体单质,应为S,Z是一种化合物,焰色反应呈黄色,应含有Na元素,0.1mol?L-1Z的水溶液pH=13,说明为一元强碱,则Z为NaOH,二者发生:3S+6OH-=2S2-+SO32-+3H2O,则C、Y、D都含同一种元素,且此元素化合价依次升高,则C为Na2S,D为Na2SO3,在酸性条件下发生反应:2S2-+SO32-+6H+=2S↓+3H2O,由于酸性:H2SO3>H2S,相同条件下,S2-水解程度大于SO32-,在高温条件下自身发生氧化还原反应:4Na2SO3
 Na2S+3Na2SO4,以此解答该题.
Na2S+3Na2SO4,以此解答该题.点评:本题考查无机物的推断和物质的组成探究,题目难度中等,本题注意把握S的单质及其化合物的性质,注意根据物质的性质选择实验方案.

练习册系列答案
相关题目
X、Y和Z是短周期元素组成的三种单质,X的组成元素是第三周期原子半径最大的元素;Y和Z均由元素R组成,Y由两个原子组成,R最外层电子数是内层电子数的3倍,下列推断正确的是( )
| A、Y和Z互为同位素 | B、X和Y能化合成两种化合物 | C、X和Y化合的产物中一定不含有共价键 | D、X离子比R的离子半径小 |