网址:http://m.1010jiajiao.com/timu_id_144036[举报]
9.C 10.B 11.A 12.A 13.D 14.D 15.C
28 (13分)
(1) HNO3 NH3 .files/image024.gif) H2O NH4NO3 (3分)
H2O NH4NO3 (3分)
(2)2Al+2OH- +6H2O=====2[Al(OH)4]- +3H2 Ó 或2Al+2OH- +2H2O====2AlO2- +3H2Ó(2分);
(3)I.<(2分) II K1/K2;66.67%(4分)
(4)N2+8H+ +6e- =======2NH4+(2分)
29.(15分)
(1)①NaNO2(2分);0.8(2分 ) ②b、c(2分 )
(2)①Fe3+>Cu2++>Fe2+(2分)
②方案:将铜棒与碳棒用导线连接,再插入氯化铁溶液,发现有电流产生(3分)
(3)①Cu2+、Fe2+(2分)
②1.0.files/image026.gif) 10-17(mol
10-17(mol.files/image024.gif) L-1)3(2分)
L-1)3(2分)
30(14分)
(1) C(2分)
(2) 避免 Na2SO3==== Na2S+ 2 Na2SO4(2分)
(3)
4 Na2SO3.files/image029.gif) 3
Na2SO4(2分)
3
Na2SO4(2分)
(4)
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO2-3,的溶液的碱性强,pH增大(2分);S2-+H2O.files/image009.gif) HS-+HO-(2分)
HS-+HO-(2分)
(5)
取 ③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-(或向其中加新制氯水,如有浑浊出现,则证明有S2-)(2分),另取③中溶液适量于试管中,加入HCL酸化的BaCL2溶液,如有白色沉淀 证明SO2-4.files/image031.gif) 38(8分)
38(8分)
31.(8分)
(1) 苯环,醛基(1分);
(2) D(1分)
(3)
.files/image032.gif)
(4)4分(2分)
 (2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
(2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.(1)钢铁“发蓝,,是将钢铁制品浸到某些氧化性溶液中,使其表面形成一层四氧化三铁的过程.其中有一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热至1300C,反应过程为:
I.3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
II.6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑十+7NaOH
Ⅲ.Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①反应II中的氧化剂是
②上述过程产生了大量NH3,有关NH3处理方案合理的是
a.用H2SO4吸收制氮肥 b. 高空排放 C.用于制备HNO3
(2)工业上常用氯化铁溶液腐蚀铜制电路板.
①请根据金属活动顺序及反应原理,判断Cu2+、Fe3+、Fe2+的氧化性强弱顺序:
②请设计实验验证Cu2+、Fe3+氧化性强弱的结论.实验方案及现象为:
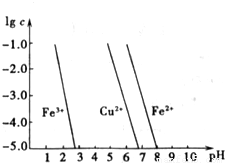
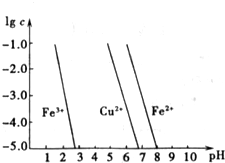
(3)如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5 mol?L-1时,可认为沉淀完全),试回答:
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(1)钢铁“发蓝,,是将钢铁制品浸到某些氧化性溶液中,使其表面形成一层四氧化三铁的过程.其中有一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热至130C,反应过程为:
I.3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
II.6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑十+7NaOH
Ⅲ.Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①反应II中的氧化剂是 .
②上述过程产生了大量NH3,有关NH3处理方案合理的是
a.用H2SO4吸收制氮肥 b. 高空排放 C.用于制备HNO3
(2)工业上常用氯化铁溶液腐蚀铜制电路板.
①请根据金属活动顺序及反应原理,判断Cu2+、Fe3+、Fe2+的氧化性强弱顺序: .
②请设计实验验证Cu2+、Fe3+氧化性强弱的结论.实验方案及现象为: .
(3)如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值,试回答:
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 .
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]= .
 查看习题详情和答案>>
查看习题详情和答案>>
 铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
(1)钢铁“发蓝,,是将钢铁制品浸到某些氧化性溶液中,使其表面形成一层四氧化三铁的过程.其中有一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热至1300C,反应过程为:
I.3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
II.6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑十+7NaOH
Ⅲ.Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①反应II中的氧化剂是______.
②上述过程产生了大量NH3,有关NH3处理方案合理的是______
a.用H2SO4吸收制氮肥 b. 高空排放 C.用于制备HNO3
(2)工业上常用氯化铁溶液腐蚀铜制电路板.
①请根据金属活动顺序及反应原理,判断Cu2+、Fe3+、Fe2+的氧化性强弱顺序:______.
②请设计实验验证Cu2+、Fe3+氧化性强弱的结论.实验方案及现象为:______.
(3)如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5 mol?L-1时,可认为沉淀完全),试回答:
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为______.
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=______.
查看习题详情和答案>>
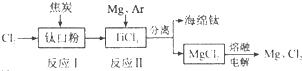
有关说法正确的是( )
| A、反应Ⅰ中钛白粉(TiO2)作氧化剂 | ||||
B、反应Ⅱ的化学方程式为:2Mg+TiCl4
| ||||
| C、可以用N2代替Ar作为反应II中的保护气 | ||||
| D、该工艺中可以循环使用的物质只有Cl2 |
I.金红石、炭粉混合,在高温条件下通入氯气制得TiCl4:
aTiO2+bCl2+cC
| ||
II.在氩气的气氛中,用过量镁在高温条件下与TiCl4反应制得金属钛:
TiCl4+2Mg
| ||
以下关于反应 I、II的分析:①TiCl4在反应 I中是氧化产物,在反应 II中是氧化剂;②反应 I和反应 II中的还原剂分别为碳和镁;③可以确定a=1,b=c=2;④反应 II得到的金属钛中含有过量的Mg,冷至室温后,可用盐酸洗去未反应的Mg;⑤在反应 I、II中,每生成19.2gTi,共转移电子1.6mol.其正确的组合( )