题目内容
铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.(1)钢铁“发蓝,,是将钢铁制品浸到某些氧化性溶液中,使其表面形成一层四氧化三铁的过程.其中有一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热至130C,反应过程为:
I.3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
II.6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑十+7NaOH
Ⅲ.Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①反应II中的氧化剂是 .
②上述过程产生了大量NH3,有关NH3处理方案合理的是
a.用H2SO4吸收制氮肥 b. 高空排放 C.用于制备HNO3
(2)工业上常用氯化铁溶液腐蚀铜制电路板.
①请根据金属活动顺序及反应原理,判断Cu2+、Fe3+、Fe2+的氧化性强弱顺序: .
②请设计实验验证Cu2+、Fe3+氧化性强弱的结论.实验方案及现象为: .
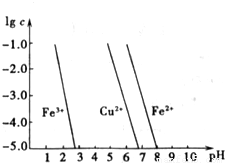
(3)如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值,试回答:
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 .
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]= .
【答案】分析:(1)①根据化合价的变化判断;
②氨气不能排放到空气中,为碱性气体,可用酸吸收;
(2)①根据反应2Fe3++Cu=2Fe2++Cu2+,Fe+Cu2+=Fe2++Cu进行判断;
②可根据反应2Fe3++Cu=2Fe2++Cu2+,设计成原电池反应;
(3)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀;
②根据Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)计算.
解答:解:(1)①反应II中NaNO2的N元素化合价降低,应为氧化剂,故答案为:NaNO2;
②氨气不能排放到空气中,为碱性气体,可用酸吸收,用以制备氮肥,故答案为:a c;
(2)①根据反应2Fe3++Cu=2Fe2++Cu2+,可判断出氧化性:Fe3+>Cu2+,
根据Fe+Cu2+=Fe2++Cu可判断出氧化性:Cu2+>Fe2+,所以有氧化性:Fe3+>Cu2+>Fe2+,
故答案为:Fe3+>Cu2+>Fe2+;
②根据反应2Fe3++Cu=2Fe2++Cu2+,设计成原电池反应,可验证Cu2+、Fe3+氧化性的强弱,可将铜棒与碳棒用导线连接(带电流表),再插入氯化铁溶液,发现有电流产生,
故答案为:将铜棒与碳棒用导线连接(带电流表),再插入氯化铁溶液,发现有电流产生;
(3)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀,
溶液中存在的金属阳离子为Cu2+、Fe2+,
故答案为:Cu2+、Fe2+;
②由图象可知:c(Fe2+)=1.0×10-5(mol?L-1),c(OH-)=1.0×10-6(mol?L-1)
Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)=1.0×10-17(mol?L-1)3,
故答案为:1.0×10-17(mol?L-1)3.
点评:本题考查较为综合,题目难度中等,易错点为(3),注意图象纵坐标数值.
②氨气不能排放到空气中,为碱性气体,可用酸吸收;
(2)①根据反应2Fe3++Cu=2Fe2++Cu2+,Fe+Cu2+=Fe2++Cu进行判断;
②可根据反应2Fe3++Cu=2Fe2++Cu2+,设计成原电池反应;
(3)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀;
②根据Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)计算.
解答:解:(1)①反应II中NaNO2的N元素化合价降低,应为氧化剂,故答案为:NaNO2;
②氨气不能排放到空气中,为碱性气体,可用酸吸收,用以制备氮肥,故答案为:a c;
(2)①根据反应2Fe3++Cu=2Fe2++Cu2+,可判断出氧化性:Fe3+>Cu2+,
根据Fe+Cu2+=Fe2++Cu可判断出氧化性:Cu2+>Fe2+,所以有氧化性:Fe3+>Cu2+>Fe2+,
故答案为:Fe3+>Cu2+>Fe2+;
②根据反应2Fe3++Cu=2Fe2++Cu2+,设计成原电池反应,可验证Cu2+、Fe3+氧化性的强弱,可将铜棒与碳棒用导线连接(带电流表),再插入氯化铁溶液,发现有电流产生,
故答案为:将铜棒与碳棒用导线连接(带电流表),再插入氯化铁溶液,发现有电流产生;
(3)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀,
溶液中存在的金属阳离子为Cu2+、Fe2+,
故答案为:Cu2+、Fe2+;
②由图象可知:c(Fe2+)=1.0×10-5(mol?L-1),c(OH-)=1.0×10-6(mol?L-1)
Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)=1.0×10-17(mol?L-1)3,
故答案为:1.0×10-17(mol?L-1)3.
点评:本题考查较为综合,题目难度中等,易错点为(3),注意图象纵坐标数值.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
(2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛. 铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.