网址:http://m.1010jiajiao.com/timu_id_14221[举报]
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
C
D
C
C
C
A
D
C
B
二、选择题
题号
11
12
13
14
15
答案
AB
A
A
AB
B
三、填空、简答和计算
16.1, 失去,+1;增大,减弱,增强;Cs 。
17.(1) ①②③④ (2) ①②③④②
18. 4KO2+2CO2==2K3CO3+3O2 , 48 , 0.6 , 能。
19.(1)过氧化钠 (2)2Na2O2+2H2O==4NaOH+O2↑, Na2O2 ,Na2O2。
20.Na2CO3、Na2SO4、BaCl2;CuCl2、K2CO3、K2SO4;NaCl。
21.设合金中含有K和与水反应生成H2的质量分别为x和y.
2K + 2H2O==2KOH + H2↑ 2 Na + 2H2O==4NaOH + H2↑
78 2 46 2
39x x 23y y
则有:x+y=
39x+23y=
联立①②,解得x=
所以钠的质量分数:w(Na)=0.544X23/69.3=0.181
合金中钾、钠的原子个数比= ∶
∶ =233∶87
=233∶87
答:合金中钠的质量分数为0.181,钾和钠原子个数比为233∶87。
22.解:设此碱金属的相对原子质量为M,则
假设
R ~ ROH
M (17+M)
M:(17+M)=10.8:16, M=35.3
假设
R2O ~ 2ROH
(
(
由平均值原理,10.7<M<35.3,符合此条件的碱金属为钠(23)。
设

解之得:x=
答:该碱金属是钠,其混合物中Na为
 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有
②滴定时选择的指示剂为甲基橙.当溶液
③为减少偶然误差,通常的处理办法是
④滴定时若锥形瓶内有少量液体溅出,则测定结果
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为
| 53(W3-W1) |
| 22W2 |
| 53(W3-W1) |
| 22W2 |
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是

I.请根据上面流程,圆答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2
(3)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是
| 1120(W2-W1) |
| 160a |
| 1120(W2-W1) |
| 160a |
II.有同学提出,还可以采用以下方法来测定:

(4)在量取待测液和滴定过程中需要用到的滴定管是
A.一支酸式滴定管和一支碱式滴定管 B两支酸式滴定管 C两支碱式滴定管
(5)滴定终点的现象为
(6)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是
| 14bc |
| 5a |
| 14bc |
| 5a |
(7)在试验过程中,下列操作可能造成铁元素的质量分数偏高的是
A.溶解样品时用稀盐酸代替稀硫酸
B.用铁单质做还原剂
C.量取滤液时未润洗对应滴定管
D.滴定前读数时满定管内无气泡,滴定后有气泡残留在滴定管尖端
E.配制c mol/L KMnO4标准溶液时未将洗涤液一并转移入容量瓶
F.试验时在锥形瓶中放了25.5mL含有Fe2+的待测液.
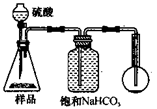
(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为: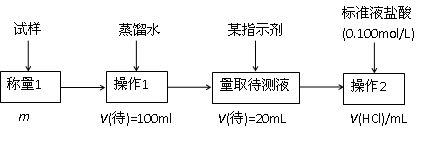
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图: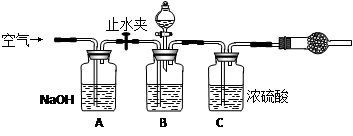
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)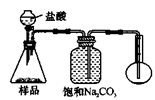
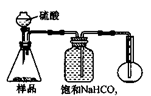
A B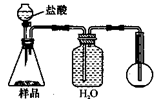
C D
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol·L﹣1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH_______7(填“=”“>”或“<”)。
(2)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明________(填字母)
A.该Na2S2O3溶液中水电离的c(OH﹣)=10﹣8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32﹣+2H2O=H2S2O3+2OH﹣
写出实验②发生反应的离子方程式 。
(3)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O(摩尔质量为248g/mol)的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗KMnO4溶液体积20.00 mL。(已知:5S2O32﹣+8MnO4﹣+14H+=8Mn2++10SO42﹣+7H2O)。
试回答:
①KMnO4溶液置于——(填“酸式”或“碱式”)滴定管中,滴定终点的现象为 。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果_____________(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。
查看习题详情和答案>>
(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:

①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图:

操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)


A B


C D
查看习题详情和答案>>