网址:http://m.1010jiajiao.com/timu_id_14164[举报]
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
D
B
B
A
A
C
B
C
二、选择题
题号
11
12
13
14
15
答案
A
CD
C
AC
D
三、填空、简答和计算
17.(1) g?mol-1 (2)
g?mol-1 (2)
18.(1)11 mol、10 mol、10 mol;(2)1.204×1023
19.A,A,D,D,
20. 24,40,56
21.据题意有 A + B ==== C + D
16 20 W 4.5
根据质量守恒定律W=16+20-4.5=
A+B====C+D

x=15.75(g)
所以C的摩尔质量为 =
=
22. 设参加反应的锌的物质的量为x, 析出铜的物质的量为y, 生成ZnSO4的物质的量为z.
CuSO4 + Zn = ZnSO4 + Cu 质量增加
1mol 1mol 1mol 1mol
x
z y
解得:x=0.1mol y=0.1mol z=0.1mol
生成ZnSO4的质量:m(ZnSO4)=
答:略。
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] ?3H2O。
42.2g K4[Fe(CN)6] ?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题: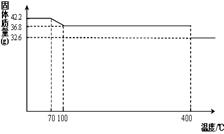
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol?L-1的KCN(pH>7)溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol?L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol?L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了;)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] ?3H2O。
42.2g K4[Fe(CN)6] ?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题:
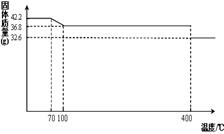
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol?L-1的KCN(pH>7)溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol?L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol?L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了;)
查看习题详情和答案>>
42.2g K4[Fe(CN)6] ?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题:
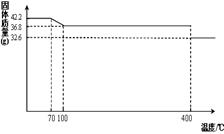
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol?L-1的KCN(pH>7)溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol?L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol?L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了;)
硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物,在科学技术和生成中有重要的应用.根据题意完成下列计算:
(1)由硫与限量氯气在50~60°C反应16~20小时,可恰好完全反应,得到两种硫的氯化物A和B.A物质中的含硫量为0.131,B物质中的含氯量为0.816,A的相对分子质量比B大71.计算确定这两种氯化物的分子式分别为______.若上述反应得到的A、B的物质的量比为3:2,则参加反应的S和氯气的物质的量之比为______.
(2)硫的卤化物或卤氧化物都有强水解性,可以作脱水剂.SF4吸收V mL液态水(4℃),完全反应,得到3.2g SO2气体(假设SO2完全逸出)和10%的酸溶液,计算吸收的液态水的体积V为______mL.
(3)S4N4是亮橙色固体,不溶于水和有机溶剂,是一种重要的金属有机化学反应物.一般用S2Cl2、SCl2的惰性溶剂(CS2)氨解制得:6S2Cl2+16NH3→S4N4+S8+12NH4Cl;24SCl2+64NH3→4S4N4+S8+48NH4Cl.S2Cl2、SCl2的混合液体52.86g溶于足量的CS2中,再通入35.84L氨气(标准状况)完全氨解,产生14.080g硫单质.剩余氨气用40g水完全吸收形成氨水(密度为0.923g/mL).
计算:①该混合液体中S2Cl2、SCl2的物质的量之比为______.
②所得氨水的物质的量浓度为______(保留1位小数).
(4)S4N4与Ag在一定条件下反应,失去N2而缩合成(SN)x,(SN)x合成于1910年,过了五十年,才发现它在0.26K的低温下,可转变为超导体(superconductor).(SN)x的结构式如图:

已知1.20×105 mol S4N4与Ag发生缩合,失去了1.20×105 mol N2,生成二百聚物[(SN)200]和三百聚物.测得缩合产物中二百聚物的质量分数为0.50.
计算:①缩合产物中各缩合物的物质的量.
②若Ag的实际使用量为8.64kg,求Ag的循环使用次数.
查看习题详情和答案>>
(1)写出XY2分子的电子式
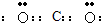
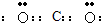
(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
| ||
| ||
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是
| ||
| △ |
| ||
| △ |