网址:http://m.1010jiajiao.com/timu_id_139560[举报]
一、 选择题(每题2分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
D
B
C
A
B
C
C
B
C
A
C
C
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
A
C
D
D
D
A
D
D
A
D
A
C
二、填空题(本题包括6小题,共计30分)
26. O2+2H2O+4e-=4OH- (1分) 略 (2分)
27. ⑦③⑨①②④⑧⑥⑤ (2分)
28. n-1 (2分)
29.(1)其它离子也沉淀 (1分)
(2)把Fe2+氧化成Fe3+ ;(1分) 增大;(1分) 不妥(1分)引入了钠离子(1分)
(3)BC (2分) (4)CD (2分)
30.(1) 124.24. (1分) (2)2×10-7 mol?L-1; (1分)
(3)> (1分) HCO3-CO32-+H+
HCO3-+H2OH2CO3+OH-、HCO3-的水解程度大于电离程度 (2分)
31.(1)Y (1分) a和c (1分)
(2)0.04 mol?L-1min ; (1分)Kb=(mol?L-1)-1(或mol-1?L); (1分)= (1分)
(3)a,b C(2分) (4)C (2分)
三.实验题(8分)
32. I.无色变红色且半分钟不褪去 (1分) C (1分)
II(1)2MnO4-+10Fe2++16H+=2Mn2++10Fe3++8H2O;(2分)(2) 0.8 mol (2分) (3) AD(2分)
四、计算题(12分)
33、(1)2CuSO4+2H2O=2Cu+O2+2H2SO4 (2分)(2)1.4;(1分) 2:1 (1分)(3)5(2分)
34、(1)消耗的O2物质的量: (1分)
生成的SO3物质的量:
SO2和SO3的物质的量和:
反应前的SO2物质的量: (2分)
SO2的转化率: (1分)
(2)在给定的条件下,溶液呈强酸性,BaSO3不会沉淀。因此BaSO4的质量 (2分)
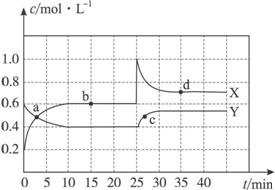
(1)图中共有两条曲线X和Y,其中曲线______________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是____________________________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=______________mol·L-1·min-1。
②15 min时,反应2NO2(g)![]() N2O4(g)在b点的平衡常数K(b)=______________。
N2O4(g)在b点的平衡常数K(b)=______________。
③25 min时还可以采取的措施是__________________________________________。
④35 min时,反应2NO2(g)![]() N2O4(g)在d点的平衡常数K(d)________________K(b)(填“>”“=”或“<”)。
N2O4(g)在d点的平衡常数K(d)________________K(b)(填“>”“=”或“<”)。
(3)①若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是____________。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小玻璃容器的体积至
 已知NO2和N2O4可以相互转化:2NO2(g)
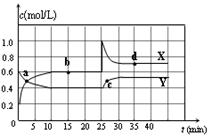
已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化
N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化
关系如右图。下列说法正确的是
A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线
B.前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L·min)
C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L
D.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态
查看习题详情和答案>>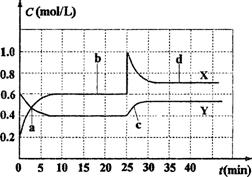 已知NO2和N2O4可以相互转化:2NO2(g)
已知NO2和N2O4可以相互转化:2NO2(g) ![]() N2O4(g);ΔH <0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g);ΔH <0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
A.图中共有两条曲线X和Y,其中曲线X表示NO2 浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡 状态的点是b和d
C.反应进行至25 min时,曲线发生变化的原因是 加入0.4molN2O4
D.若要达到与d相同的状态,在25 min时还能采 取的措施是适当缩小容器体积
查看习题详情和答案>>(11分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。
②反应2NO2(g) N2O4(g)在b点的平衡常数K(b)= 。
③反应2NO2(g) N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d) K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是 (填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是
查看习题详情和答案>>
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g);△H<0。现将一定量NO2和 N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g);△H<0。现将一定量NO2和 N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是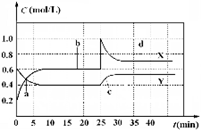
| A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积 |
| D.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |