网址:http://m.1010jiajiao.com/timu_id_137803[举报]
题号
1
2
3
4
5
6
7
8
答案
C
D
B
B
D
C
A
A
题号
9
10
11
12
13
14
答案
CD
AD
C
A
BD
B
15、(本题共10分)
(1)CO32-水解成碱性,Cu2+与OH‑结合生成Cu(OH)2 (合理给分)。 (2分)
(2)取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净。(2分)
(3)CuSO4、澄清石灰水 (每个1分,名称和化学式搞混不给分,共2分)
(4)B中无水硫酸铜变蓝,澄清石灰水不变浑浊(每点1分,共2分)
(5)装置中原有的空气有影响;实验结束后装置中残留的气体不能被吸收;石灰水可能会吸收空气中的CO2。(2分,说出二点即可)
16、(本题共8分)
(1)腐蚀建筑物、桥梁、工业设备、运输工具;直接破坏农作物、草原、森林;使土壤、湖泊酸化。(说出其中二点即可)(2分)
(2)铁粉和稀硫酸(2分)
(3) 2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+ (2分)
(4) FeSO4?7H2O (2分)
17、(本题共10分)
(1) A D (每个1分,共2 分,有错不给分)
(2) A
(3) X=2 (2分) , A (2分)
(4) 1/1620(或6.17×10-4) (2分)
18.(10分)
(1)重金属离子会使蛋白质变性(2分)
(2)① Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2分)
② Cr3+ + 4OH- = CrO2- + 2H2O (2分)
③ 8~10 (2分)
(3)② (以下任意2条即可)(2分)
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高;
酸性环境对Cr元素浸出有抑制作用;
冻融对Cr元素浸出影响不明显;
曝晒对Cr元素浸出影响不明显;
……
19、(共12分)
(1)消去反应 (1分)
(2) 、CH3CHO、
、CH3CHO、 (每空1分,共3分)
(每空1分,共3分)
(3)CH3COOCH2CH3、CH3CH2COOCH3、CH3CH2CH2COOH、(CH3)2CHCOOH
(对一个得1分,错一个倒扣1分,共4分)
(4)CH3CH(OH)CH(OH)CH3 +
(5) (2分)
(2分)
 20.(10分)
20.(10分)
⑴ 16.8 (2分)
⑵NO3―
(每个2分,共6分)
(3)解:3Fe2+ + NO3- + 4H+ = 3Fe3++NO↑+2H2O
0.3mol 0.6mol 0.2mol
Fe2+、NO3-过量,故产生NO气体:0.2mol÷4×
21.(每小题2分,共12分)
(1)H2S、NH2- (2)A (3)BC
(4)3d104s1 Cr (5)共价键、配位键
(6)降低Cu(NH3)4SO4?H2O的溶解度
汞(Hg)、铬(Cr)是影响环境污染、生物效应和人类健康的重金属元素。
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为 。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。

(2)加过量FeSO4的目的是 。
(3)配平步骤①的反应的离子方程式 Fe2++ Cr2O72—+ _____== Fe3++ Cr3++ H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
|
样品序号 |
取样深度(m) |
有机质(×10—2g) |
总铬(×10—6g) |
|
样品A-1 |
0.00 ~ 0.30 |
2.81 |
114 |
|
样品A-2 |
0.30 ~ 0.60 |
1.72 |
111 |
|
样品A-3 |
1.20 ~ 1.80 |
1.00 |
88 |
|
样品B-1 |
0.00 ~ 0.30 |
2.60 |
116 |
|
样品B-2 |
0.30 ~ 0.60 |
2.48 |
112 |
|
样品B-3 |
1.20 ~ 1.80 |
1.83 |
106 |
从表中你可以得出的结论有 (答一点即可)。
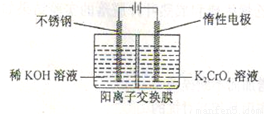
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+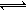 Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
查看习题详情和答案>>
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为 。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。

(2)加过量FeSO4的目的是 。
(3)配平步骤①的反应的离子方程式 Fe2++ Cr2O72—+ _____="=" Fe3++ Cr3++ H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
| 样品序号 | 取样深度(m) | 有机质(×10—2g) | 总铬(×10—6g) |
| 样品A-1 | 0.00 ~ 0.30 | 2.81 | 114 |
| 样品A-2 | 0.30 ~ 0.60 | 1.72 | 111 |
| 样品A-3 | 1.20 ~ 1.80 | 1.00 | 88 |
| 样品B-1 | 0.00 ~ 0.30 | 2.60 | 116 |
| 样品B-2 | 0.30 ~ 0.60 | 2.48 | 112 |
| 样品B-3 | 1.20 ~ 1.80 | 1.83 | 106 |
从表中你可以得出的结论有 (答一点即可)。
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O
 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
铬(Cr)属于重金属元素,含铬的废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第______周期。
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。已知:
①FeSO4还原Cr2O72-的离子方程式为______________________________________________。
②Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为_____________________。
③沉淀法分离废水中的Cr3+,pH应控制的范围是________。
④下列关于铬及其化合物的说法中正确的是________。
A.K2Cr2O7是一种常用的强氧化剂
B.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
C.金属铬硬度大、耐腐蚀,是常用的镀层金属
(1)铬原子核中质子数为24,铬位于周期表中第______周期。
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。已知:

①FeSO4还原Cr2O72-的离子方程式为______________________________________________。
②Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为_____________________。
③沉淀法分离废水中的Cr3+,pH应控制的范围是________。
④下列关于铬及其化合物的说法中正确的是________。
A.K2Cr2O7是一种常用的强氧化剂
B.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
C.金属铬硬度大、耐腐蚀,是常用的镀层金属

 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O