摘要:56%电解8选择
网址:http://m.1010jiajiao.com/timu_id_127353[举报]
已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L—1、0.0010 mol· L—1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L—1)的用量均为2 mL。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
| 实验编号 | 溶液褪色所需时间 t / min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.5 | 6.7 | 6.8 |
某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
分析表中数据,下列说法中不正确的是( )
| 实验编号 | ① | ② | ③ |
| 盐酸体积/mL | 50 | 50 | 50 |
| M(混合物)/g | 9.2 | 26.56 | 36.8 |
| V(CO2)(标准状况)/L | 2.24 | 4.48 | 4.48 |
| A、由①、②可知:①中的盐酸过量 |
| B、由②、③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经反应完全 |
| C、所用盐酸的物质的量浓度为0.4 mol?L-1 |
| D、该混合物中NaHCO3的物质的量分数为50% |
海水蕴含着丰富的资源.在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程:
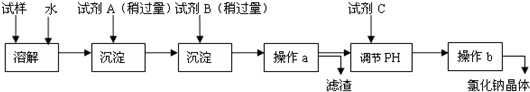
请回答以下问题:
(1)在所提供的试剂中选择:试剂B是
①Na2CO3②BaCl2③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、
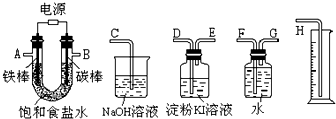
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积.试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接
(4)电解氯化钠溶液时的离子方程式为
(5)若装入的饱和食盐水为75mL,接通电源一段时间,停止通电后,测得氢气为8.4mL(标准状况).将U形管内的溶液混合均匀,其pH约为
查看习题详情和答案>>

请回答以下问题:
(1)在所提供的试剂中选择:试剂B是
①
①
①Na2CO3②BaCl2③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、
蒸发皿
蒸发皿
、三脚架和玻璃棒.
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积.试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接
G
G
,F
F
接H
H
;B接D
D
,E
E
接C
C
.(4)电解氯化钠溶液时的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
;
| ||
(5)若装入的饱和食盐水为75mL,接通电源一段时间,停止通电后,测得氢气为8.4mL(标准状况).将U形管内的溶液混合均匀,其pH约为
12
12
.(假设电解前后溶液体积变化可忽略不计,产生的气体全部逸出)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol?L-1的盐酸来滴定待测溶液,不可选用
(A)甲基橙 (B)石蕊 (C)酚酞
(3)根据你所选择的指示剂,正确判断滴定终点的现象是:
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
(5)下列实验操作会对滴定结果产生的后果.(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果
查看习题详情和答案>>
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在
A
A
(填编号字母)上称量(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol?L-1的盐酸来滴定待测溶液,不可选用
B
B
(填编号字母)作指示剂.(A)甲基橙 (B)石蕊 (C)酚酞
(3)根据你所选择的指示剂,正确判断滴定终点的现象是:
滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色
滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色
.(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
0.4000
0.4000
mol?L-1,烧碱样品的纯度是97.56%
97.56%
.| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果
偏高
偏高
.②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果
偏高
偏高
.废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂.

(1)在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的离子方程式为
(2)除杂时通入空气的目的
(3)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如图乙.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阴极的电极反应式是
②b中,生成Li2CO3反应的化学方程式是
查看习题详情和答案>>

(1)在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的离子方程式为
S2O32ˉ+8LiCoO2+22H+═2SO42ˉ+8Li++8Co2++11H2O
S2O32ˉ+8LiCoO2+22H+═2SO42ˉ+8Li++8Co2++11H2O
.| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
,所得的废渣成分为Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
.从废渣中获得Al2O3的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
,步骤Ⅱ中反应的离子方程式是2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32ˉ或
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32ˉ或
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
.AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
(3)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如图乙.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阴极的电极反应式是
2H++2e-═H2↑或2H2O+2e-═H2+2OH-
2H++2e-═H2↑或2H2O+2e-═H2+2OH-
.②b中,生成Li2CO3反应的化学方程式是
2LiOH+2NH4HCO3═Li2CO3↓+(NH4)2CO3
2LiOH+2NH4HCO3═Li2CO3↓+(NH4)2CO3
.