摘要:(5)CH3CH2OHCH2=CH2↑+H2O↑
网址:http://m.1010jiajiao.com/timu_id_116369[举报]
(2011?上海模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E是人体内含量最高的金属元素.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的非金属性由强到弱的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式
 ;一种由B、C组成的化合物与AC2电子数相等,其化学式为
;一种由B、C组成的化合物与AC2电子数相等,其化学式为
(4)E的核外电子排布式是
(5)10molB的最高价氧化物对应的水化物的稀溶液与4molD的单质反应时,B被还原到最低价,B被还原后的产物化学式为
查看习题详情和答案>>
(1)A、B、C的非金属性由强到弱的顺序为
O>N>C
O>N>C
.(2)B的氢化物的分子空间构型是
三角锥型
三角锥型
.它是极性分子
极性分子
(填极性和非极性)分子.(3)写出化合物AC2的电子式


N2O
N2O
.(4)E的核外电子排布式是
1s22s22p63s23p64s2
1s22s22p63s23p64s2
,(5)10molB的最高价氧化物对应的水化物的稀溶液与4molD的单质反应时,B被还原到最低价,B被还原后的产物化学式为
NH4NO3
NH4NO3
.(2011?上海模拟)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO?2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应是
(2)前2s内的平均反应速度v(N2)=
(3)此反应的平衡常数表达式为K=
.
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
查看习题详情和答案>>
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应是
放热
放热
反应(填写“吸热”、“放热”).(2)前2s内的平均反应速度v(N2)=
1.875×10-4mol/L?s
1.875×10-4mol/L?s
.(3)此反应的平衡常数表达式为K=
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
CD
CD
.A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
(2009?浙江)单晶硅是信息产业中重要的基础材料.通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式
(2)装置A中g管的作用是
装置E中的h瓶需要冷却的理由是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
查看习题详情和答案>>

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)装置A中g管的作用是
平衡压强,使液体顺利流出并防止漏气
平衡压强,使液体顺利流出并防止漏气
;装置C中的试剂是浓硫酸
浓硫酸
;装置E中的h瓶需要冷却的理由是
产物SiCl4沸点低,需要冷凝收集
产物SiCl4沸点低,需要冷凝收集
.(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
Al、P、Cl
Al、P、Cl
(填写元素符号).(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
否
否
(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点
KMnO4溶液的紫红色可指示反应终点
.②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
4.480%
4.480%
.(2011?上海模拟)为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1mol?L-1的KI溶液,滴加0.1mol?L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想.
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
②写出操作“步骤一”中发生反应的离子方程式
查看习题详情和答案>>
(Ⅰ)取5mL0.1mol?L-1的KI溶液,滴加0.1mol?L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为
溶液呈棕黄色
溶液呈棕黄色
、溶液分层,下层CCl4层呈紫色
溶液分层,下层CCl4层呈紫色
.(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想.
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 | 现象 | 结论 |
| 步骤一: 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 |
产生蓝色沉淀 | 猜想一不成立 猜想一不成立 |
| 步骤二: 往探究活动III溶液中加入乙醚,充分振荡 往探究活动III溶液中加入乙醚,充分振荡 |
乙醚层呈血红色 乙醚层呈血红色 |
“猜想二”成立 |
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓
.(2011?上海模拟)烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:
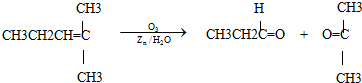
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C.化合物B含碳69.8%,含氢11.6%,B无银镜反应.D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E.G的分子式为C7H14O2C7H14O2.有关转化关系如下;
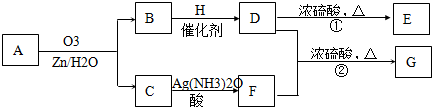
(1)B的相对分子质量是
(2)写出结构简式:A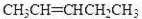
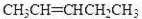 .
.
(3)写出反应①、②的反应类型:①
(4)写出反应②的化学方程式: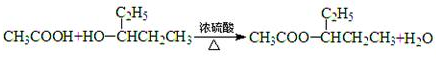
 .
.
(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为
查看习题详情和答案>>
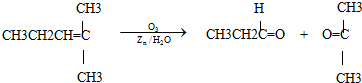
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C.化合物B含碳69.8%,含氢11.6%,B无银镜反应.D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E.G的分子式为C7H14O2C7H14O2.有关转化关系如下;

(1)B的相对分子质量是
86
86
.(2)写出结构简式:A
(CH3CH2)2C=CHCH2CH3
(CH3CH2)2C=CHCH2CH3
、E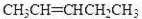
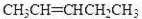
(3)写出反应①、②的反应类型:①
消去反应
消去反应
、②酯化反应
酯化反应
.(4)写出反应②的化学方程式:


(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为
HOCH2CHO
HOCH2CHO
.