摘要:乙:I.(1)ClO-+H2OHClO+OH-
网址:http://m.1010jiajiao.com/timu_id_116358[举报]
(2011?双流县模拟)I.硫酸铁糖衣药片是一种治疗缺铁性贫血的药剂.某化学课外活动小组测定其中铁元素含量的实验步骤如下:

(1)刮除药片糖衣称得样品ag,将其研碎后迅速溶解,配制溶液.操作如图所示,操作是否正确,
(2)洗涤的目的是除去附着在沉淀上的
(3)将沉淀物灼烧,冷却至室温,称得其质量为b1g,再次灼烧并冷却至室温称得其质量为b2 g,若b1-b2=0.3,则接下来的操作
(4)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是
(用化学方程式表示)
II.某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失.大家经查阅资料后发现,可能的原因是发生了下列反应:AgI+I- [AgI2]-
[AgI2]-
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验.
实验l:向浓Ⅺ溶液中滴加AgNO3溶液,观察到无沉淀生成.
实验2:向AgNO3溶液中滴加Ⅺ溶液,有黄色沉淀生成;再
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀.请解释出现沉淀的原因
(3)丙同学在实验所得的溶液中,滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色.大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是
同学们通过查阅资料知道,AgCl沉淀能溶于浓氨水.请写出这一反应的离子方程式
查看习题详情和答案>>

(1)刮除药片糖衣称得样品ag,将其研碎后迅速溶解,配制溶液.操作如图所示,操作是否正确,
不正确
不正确
,如不正确,说明原因(正确可不填写)
(2)洗涤的目的是除去附着在沉淀上的
NH4+、Cl-、SO42-、OH-、
NH4+、Cl-、SO42-、OH-、
.(写离子符号)(3)将沉淀物灼烧,冷却至室温,称得其质量为b1g,再次灼烧并冷却至室温称得其质量为b2 g,若b1-b2=0.3,则接下来的操作
再次加热,并置于干燥器中冷却,称量,直至两次质量差不超过0.1克为止
再次加热,并置于干燥器中冷却,称量,直至两次质量差不超过0.1克为止
,后通过计算可得出结果.(4)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(用化学方程式表示)
II.某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失.大家经查阅资料后发现,可能的原因是发生了下列反应:AgI+I-
 [AgI2]-
[AgI2]-(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验.
实验l:向浓Ⅺ溶液中滴加AgNO3溶液,观察到无沉淀生成.
实验2:向AgNO3溶液中滴加Ⅺ溶液,有黄色沉淀生成;再
继续滴加KI溶液,黄色沉淀溶解
继续滴加KI溶液,黄色沉淀溶解
.(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀.请解释出现沉淀的原因
加入硝酸溶液后,硝酸将碘离子氧化,使碘离子浓度减小,平衡AgI+I-?[AgI2]-逆向移动
加入硝酸溶液后,硝酸将碘离子氧化,使碘离子浓度减小,平衡AgI+I-?[AgI2]-逆向移动
.(3)丙同学在实验所得的溶液中,滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色.大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是
AgI、AgCl的溶解度
AgI、AgCl的溶解度
.同学们通过查阅资料知道,AgCl沉淀能溶于浓氨水.请写出这一反应的离子方程式
AgCl+2NH3?H2O=[Ag(NH3)2]++Cl-+2H2O;
AgCl+2NH3?H2O=[Ag(NH3)2]++Cl-+2H2O;
.(2008?佛山一模)I.图1为向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.
请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?
(2)关于该滴定实验,从下列选项中选出最恰当的一项
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)
Ⅱ.t℃时,某稀硫酸溶液中c(H+)=10-a mol?L-1,c(OH-)=10-b mol?L-1,已知a+b=13:
(5)该温度下水的离子积常数Kw的数值为
(6)该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
查看习题详情和答案>>

请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?
否
否
(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?AB
AB
区间(若正确,此问不答).(2)关于该滴定实验,从下列选项中选出最恰当的一项
C
C
.(选填字母)
| 锥形瓶中溶液 | 滴定管 中溶液 |
选用 指示剂 |
选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
D
D
.A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)
=
=
2c(Na+).(填“>”、“<”或“=”)Ⅱ.t℃时,某稀硫酸溶液中c(H+)=10-a mol?L-1,c(OH-)=10-b mol?L-1,已知a+b=13:
(5)该温度下水的离子积常数Kw的数值为
10-13
10-13
.(6)该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
12
12
.保护环境是全球关注的问题.
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究.
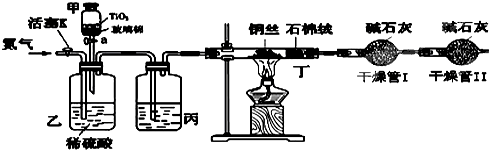
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol?L-1)加到装置甲中,塞上橡皮塞.
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关.
iii.测定干燥管I增加的质量.
(1)写出装置乙中反应的离子方程式: .
(2)装置丙中的试剂是 ,装置丁的作用是 .
(3)假定上述实验中的气体都被充分吸收.若干燥管I增重1.408g.则CN-被处理的百分率为 .
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将 (填“偏高”、“偏低”、“无法确定”或“无影响”).简述你的理由: .
Ⅱ.防治空气污染,燃煤脱硫很重要.目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果.
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2.
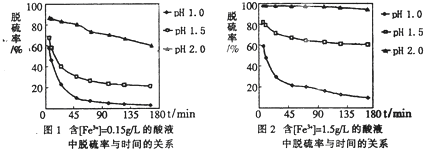
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是 、 .
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去.
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀.
上述实验方案中不合理的是 .
查看习题详情和答案>>
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究.

操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol?L-1)加到装置甲中,塞上橡皮塞.
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关.
iii.测定干燥管I增加的质量.
(1)写出装置乙中反应的离子方程式:
(2)装置丙中的试剂是
(3)假定上述实验中的气体都被充分吸收.若干燥管I增重1.408g.则CN-被处理的百分率为
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将
Ⅱ.防治空气污染,燃煤脱硫很重要.目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果.
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2.

为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去.
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀.
上述实验方案中不合理的是
有甲、乙两种物质:
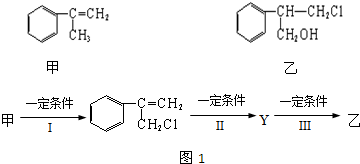
(1)乙中含有的官能团的名称为
(2)由甲转化为乙需经如图1所示的过程(已略去各步反应的无关产物,下同):其中反应I的反应类型是
 (不需注明反应条件).
(不需注明反应条件).
(3)下列物质不能与乙反应的是
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式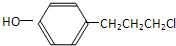 等
等 等.
等.
a.苯环上的一氯代物有两种 b.遇FeCl3溶液显示紫色.
查看习题详情和答案>>

(1)乙中含有的官能团的名称为
醇羟基、氯原子
醇羟基、氯原子
(不包括苯环).(2)由甲转化为乙需经如图1所示的过程(已略去各步反应的无关产物,下同):其中反应I的反应类型是
取代反应
取代反应
,反应II的条件是NaOH水溶液、加热
NaOH水溶液、加热
,反应III的化学方程式为

(3)下列物质不能与乙反应的是
bc
bc
(选填序号).a.金属钠 b.溴水 c.碳酸钠溶液 d.乙酸(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式
 等
等 等
等a.苯环上的一氯代物有两种 b.遇FeCl3溶液显示紫色.
已知:A、B为短周期非金属单质且均为气体;甲、乙为短周期金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
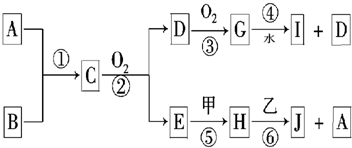
(1)写出A的电子式
(2)写出反应②的化学方程式
(3)反应④的化学方程式为
(4)反应⑤的化学方程式是
(5)反应⑥的离子方程式是
查看习题详情和答案>>

(1)写出A的电子式
H:H
H:H
、C分子的空间构型:三角锥形
三角锥形
.(2)写出反应②的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)反应④的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.(4)反应⑤的化学方程式是
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
.(5)反应⑥的离子方程式是
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
.