网址:http://m.1010jiajiao.com/timu_id_11628[举报]
一、选择题(3×16=48分)
1.C 2.D 3.C 4.B 5.C 6.D 7.A 8.A 9.A 10.D 11.C 12.B 13.C 14.A 15.D 16.D
二、(5+7+6=18分)
17.(6分)
(1)结构 性质 用途 制法(2分);结构特点(1分)
(2)BD(3分,选1个得1分,错选得0分)
18.(第二空1分,其余每空2分,共7分)
2Clˉ-2e- = Cl2↑ 升高
阻止气体分子和某些离子通过,防止氢气和氯气混合发生爆炸,并能避免氯气和氢氧
化钠溶液作用生成次氯酸钠而影响烧碱的质量
NaCl +H2O  NaClO + H2 ↑
NaClO + H2 ↑
或 2 NaCl + 2 H2O
 H2↑ +
Cl2↑+
2NaOH
H2↑ +
Cl2↑+
2NaOH
Cl2 + 2NaOH ==== NaCl + NaClO + H2O
19.(6分)
(1)接触室(1分);热交换器(1分);使反应生成的热传递给进入接触室需预热的炉气,同时冷却生成的气体(1分)
(2)
(3)小于 (1分)
三、(12+10=22分)
20.(12分)
(1)Na+[∶H]-(2分)
??(2)阳极:4OH--4e-=O2↑+2H2O(2分)
???? 阴极:4Na++4e-=4Na(2分)
??(3)NaH+HCl=NaCl+H2↑(2分)
??(4)H2、Cl2、NaOH、HCl (4分)
21. (10分)
(1)N2H4(1)+O2(g)=N2(g)+2H2O;△H=-624kJ/mol(2分)
(2)①Cu2++2e-=Cu(2分) ②112 (2分)
(3)ClO-+2NH3=N2H4+Cl-+H2O(2分)
(4)N2+6H++6e-==2NH3 (2分)
四、(14分)
22.(14分)
方案Ⅰ:偏低(1分)
方案Ⅱ:①托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶(2分)
②B (1分)
③  (1分)
(1分)
方案Ⅲ:①保证CaCO3完全分解 (1分)
②应在干燥中冷却(1分)
方案Ⅳ:①A、B (2分)
②C (1分)
③偏高(1分)
方案Ⅱ(1分)
方案Ⅰ:气体体积难以准确测量(1分)
方案Ⅲ:实验室难以提供
五、计算(8分)
23. 1.13t(写出有关化学方程式或关系式4分)
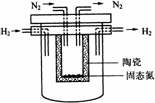
1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图.
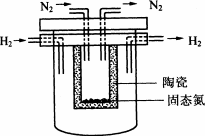
阴极的电极反应式为________.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是________.
(2)右图是一个电化学过程示意图.
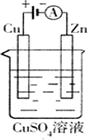
①锌片上发生的电极反应是________
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气________L(假设空气中氧气体积含量为20%)
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是________.
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图.阴极的电极反应式为________.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气,放出热量624 kJ(25℃时),N2H4完全燃烧反应的热化学方程式是__________________________.
(2)如图是一个电化学过程示意图.
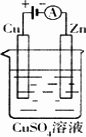
①锌片上发生的电极反应是_________________________
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128 g,则肼一空气燃料电池理论上消耗标标准状况下的空气________L(假设空气中氧气体积含量为20%)
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是______________________________________.
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图.
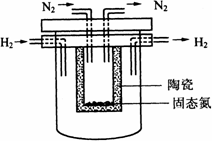
阴极的电极反应式为__________________________________.
氮元素有多种氢化物,如氨(NH3)、肼(N2H4)等。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在25℃,101kPa时,N2H4的燃烧热为624KJ/mol,又已知H2O(l)=H2O(g) △H=+44KJ/mol。则N2H4完全燃烧生成氮气和水蒸汽的热化学方程式是________________。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。 该电池放电时,负极的电极反应式是 。如果此燃料电池的能量转化率为50%,当消耗标准状况下的空气2.24L(假设空气中氧气体积含量为20%)时,此电池产生的电能为 (假设肼此时生成液态水)。
(3)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图,正极的电极反应式为______________。电池工作时,H+移向 极(填“正”、“负”)。

(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是__________(填字母)。
A采用较高压强(20—50 MPa)
B采用500 ℃的高温
C用铁触媒作催化剂
D将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)下图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法:______________________________________________________。
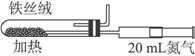
(3)在298 K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924 kJ?
___________________________________________________________________。
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
阴极的电极反应式为:__________________________________________________。
