摘要:B.1 mol该有机物与H2充分反应.消耗H2 4 mol
网址:http://m.1010jiajiao.com/timu_id_115050[举报]
 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.(1)已知:CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ?mol-1 ①
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ?mol-1 ②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1 ③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ④
反应CH4(g)+H2O(g)
| ||
+206.1
+206.1
kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移9
9
mole-,放出309.15
309.15
kJ热量.(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
增大
增大
(填“增大”、“减小”或“不变”).②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
2nA/5tAmol?(L?min)-1
2nA/5tAmol?(L?min)-1
.(用相关符号和数据表示)③判断该可逆反应达到平衡状态的标志是
bd
bd
.(填字母)a.CH3OH的生成速率与CO的消耗速率相等 b.容器中气体的压强不变
c.容器中混合气体的密度保持不变 d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是
c
c
.(填字母)a.向容器中再充入Ar b.改变反应的催化剂
c.向容器中再充入CO d.升高温度.
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
(1)已知:CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ?mol-1 ①
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ?mol-1 ②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1 ③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ④
反应CH4(g)+H2O(g)
CO(g)+3H2(g),△H=______kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移______mole-,放出______kJ热量.
(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=______,降低温度,K值______(填“增大”、“减小”或“不变”).
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.(用相关符号和数据表示)
③判断该可逆反应达到平衡状态的标志是______.(填字母)
a.CH3OH的生成速率与CO的消耗速率相等 b.容器中气体的压强不变
c.容器中混合气体的密度保持不变 d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是______.(填字母)
a.向容器中再充入Ar b.改变反应的催化剂
c.向容器中再充入CO d.升高温度.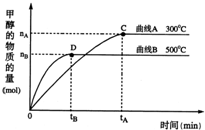
查看习题详情和答案>>
(1)已知:CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ?mol-1 ①
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ?mol-1 ②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1 ③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ④
反应CH4(g)+H2O(g)
| ||
(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=______,降低温度,K值______(填“增大”、“减小”或“不变”).
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.(用相关符号和数据表示)
③判断该可逆反应达到平衡状态的标志是______.(填字母)
a.CH3OH的生成速率与CO的消耗速率相等 b.容器中气体的压强不变
c.容器中混合气体的密度保持不变 d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是______.(填字母)
a.向容器中再充入Ar b.改变反应的催化剂
c.向容器中再充入CO d.升高温度.

利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
(1)已知:CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ?mol-1 ①
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ?mol-1 ②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1 ③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ④
反应CH4(g)+H2O(g) CO(g)+3H2(g),△H= kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移 mole-,放出 kJ热量.
CO(g)+3H2(g),△H= kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移 mole-,放出 kJ热量.
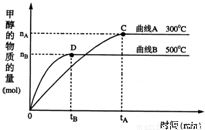
(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,降低温度,K值 (填“增大”、“减小”或“不变”).
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)= .(用相关符号和数据表示)
③判断该可逆反应达到平衡状态的标志是 .(填字母)
a.CH3OH的生成速率与CO的消耗速率相等 b.容器中气体的压强不变
c.容器中混合气体的密度保持不变 d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是 .(填字母)
a.向容器中再充入Ar b.改变反应的催化剂
c.向容器中再充入CO d.升高温度.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)已知:CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ?mol-1 ①
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ?mol-1 ②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1 ③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ④
反应CH4(g)+H2O(g)
 CO(g)+3H2(g),△H= kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移 mole-,放出 kJ热量.
CO(g)+3H2(g),△H= kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移 mole-,放出 kJ热量.(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,降低温度,K值 (填“增大”、“减小”或“不变”).
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)= .(用相关符号和数据表示)
③判断该可逆反应达到平衡状态的标志是 .(填字母)
a.CH3OH的生成速率与CO的消耗速率相等 b.容器中气体的压强不变
c.容器中混合气体的密度保持不变 d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是 .(填字母)
a.向容器中再充入Ar b.改变反应的催化剂
c.向容器中再充入CO d.升高温度.
 查看习题详情和答案>>
查看习题详情和答案>>
航天飞机座舱内空气更新过程如图所示:
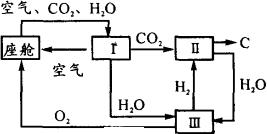
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为________.
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出O2的来源是CO2和H2O,宇航员每天消耗28 mol O2,呼出23 mol CO2,则宇航员每天呼出的气体中含有H2O________mol.
(3)以下是另一种将CO2转化为O2的实验设想(如图).
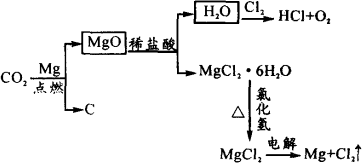
其中,由MgCl2·6H2O按图制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
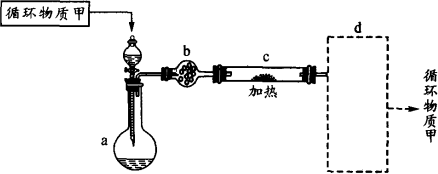
①图中,装置a由________,________,双孔塞和导管组成.
②循环物质甲的名称是________.
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是________.
④装置b中填充的物质可能是________.(填入编号)
e.硅胶 f.碱石灰 g.无水氯化钙 h.浓硫酸
⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出).
 汽车尾气已成为重要的空气污染物.
汽车尾气已成为重要的空气污染物.(1)汽车内燃机工作时引起反应:N2(g)+O2(g)=2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO 物质的量为6mol,该反应的速率v(NO)为
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为
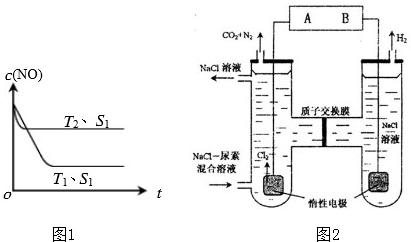
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1是反应:
2NO(g)+2CO(g)=2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图2:
①电源的负极为
②阳极室中发生的反应为
③电解结束后,阴极室溶液的pH与电解前相比将
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气的转化率,则
| a |
| b |
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正