摘要:
网址:http://m.1010jiajiao.com/timu_id_114056[举报]
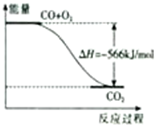 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ/mol根据以上热化学方程式,下列判断不正确的是( )
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ/mol根据以上热化学方程式,下列判断不正确的是( )
查看习题详情和答案>>
(2013?江苏三模)某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、S和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如图所示:
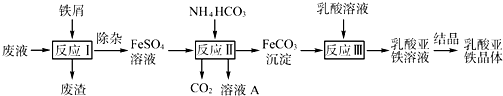
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+?2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=
.
(2)反应Ⅱ需控制反应温度低于35℃,其目的是
(3)已知:FeCO3(s)?Fe2+(aq)+C(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因:
(4)结晶过程必须控制在一定的真空度条件下进行,原因是:
查看习题详情和答案>>

(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+?2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
(2)反应Ⅱ需控制反应温度低于35℃,其目的是
防止NH4HCO3分解(或减少Fe2+的水解)
防止NH4HCO3分解(或减少Fe2+的水解)
,该反应的化学方程式是FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4
FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4
.检验溶液A中是否含Fe2+的实验操作方法是取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
.(3)已知:FeCO3(s)?Fe2+(aq)+C(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因:
C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
.(4)结晶过程必须控制在一定的真空度条件下进行,原因是:
有利于水的蒸发
有利于水的蒸发
、防止Fe2+被氧化
防止Fe2+被氧化
.A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图所示(图中部分产物未列出):
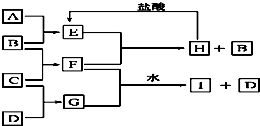
请填写下列空白:
(1)A是
(2)H与盐酸反应生成E的化学方程式是:
(3)写出E只与F反应的化学方程式是:
(4)F与G的水溶液恰好反应只生成I和D的离子方程式是:
查看习题详情和答案>>

请填写下列空白:
(1)A是
碳
碳
,C是钠
钠
.(2)H与盐酸反应生成E的化学方程式是:
Na2CO3+2HCl═CO2↑+H2O+2NaCl
Na2CO3+2HCl═CO2↑+H2O+2NaCl
.(3)写出E只与F反应的化学方程式是:
2CO2+2Na2O2═2Na2CO3+O2
2CO2+2Na2O2═2Na2CO3+O2
.(4)F与G的水溶液恰好反应只生成I和D的离子方程式是:
Na2O2+S2-+2H2O═4OH-+S↓+2Na+
Na2O2+S2-+2H2O═4OH-+S↓+2Na+
.(2010?辽宁二模)A、B、C、D、E五种单质均由短周期元素组成,在化学反应中均能形成简单的阳离子或阴离子,且B、D、E离子具有相同的电子层结构,离子半径CBDEA.常温时,A、B为气态,A和B两元素可形成2:1或1:1的共价化合物M或N.它们之间的部分转化关系如下:其中F、P和E的最高价氧化物的水化物都具有相同的摩尔质量.
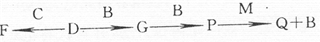
请回答下列问题:
(1)E的原子结构示意图为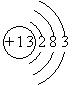
 ,F的电子式是
,F的电子式是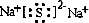
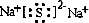 ;
;
(2)以铂作电极,Q为电解质溶液,通入A、B单质形成原电池,通入气体A的电极是
(3)N与P的化学性质具有一定的相似性,其最典型的共性是
(4)写出E与Q溶液反应的离子方程式,并指出电子转移的方向和数目
 .
.
(5)已知:4D(s)+B(g)=2G(s)△H=-akJ?mol--12D(s)+B(g)=P(s)△H=-bkJ?mol-1用化学式表示B与G反应生成P的热化学方程式
查看习题详情和答案>>
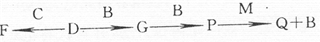
请回答下列问题:
(1)E的原子结构示意图为


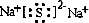
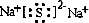
(2)以铂作电极,Q为电解质溶液,通入A、B单质形成原电池,通入气体A的电极是
负
负
极,正极的电极反应式为2H2O+O2+4e-═4OH-
2H2O+O2+4e-═4OH-
.(3)N与P的化学性质具有一定的相似性,其最典型的共性是
强氧化性
强氧化性
.(4)写出E与Q溶液反应的离子方程式,并指出电子转移的方向和数目


(5)已知:4D(s)+B(g)=2G(s)△H=-akJ?mol--12D(s)+B(g)=P(s)△H=-bkJ?mol-1用化学式表示B与G反应生成P的热化学方程式
2Na2O(s)+O2(g)2=Na2O2(s)△H=(a-2b)kJ/mol
2Na2O(s)+O2(g)2=Na2O2(s)△H=(a-2b)kJ/mol
.