网址:http://m.1010jiajiao.com/timu_id_111854[举报]
(08上海嘉定区期末)甲烷蒸气转化反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g),工业上可利用
CO(g)+3H2(g),工业上可利用
此反应生产合成氨原料气H2。
已知温度、压强和水碳比[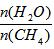 ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:
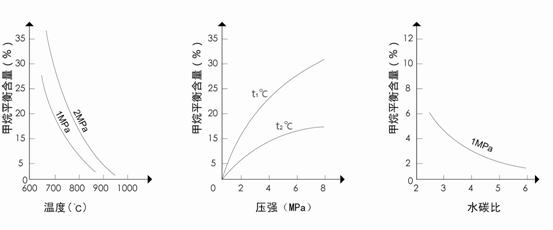
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
(1)该反应平衡常数K表达式为________________________。
(2)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);
升高温度,平衡向____________方向移动(选正反应或逆反应)。
(3)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);
图1中,在800℃、2MPa比1MPa时的甲烷含量_______(选填高、低或不变),
原因是____________________________________________________
(4)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是?
查看习题详情和答案>>工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:
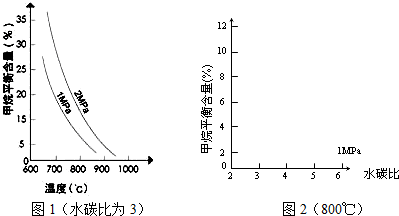
(1)温度对该反应的反应速率和平衡移动的影响是
(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图: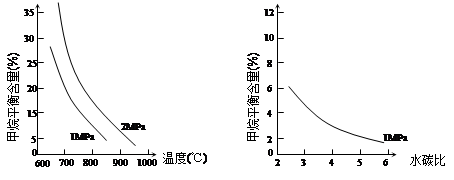
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
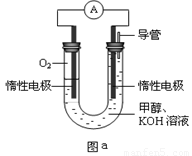
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。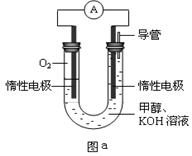
已知:CO(g) + 2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2 2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)
 CO(g)+3H2(g)。
CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:

图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。

I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g) 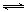 CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
CO2(g) + 3H2(g)
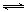 CH3OH(g)
+ H2O(g) ΔH2
CH3OH(g)
+ H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)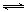 CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
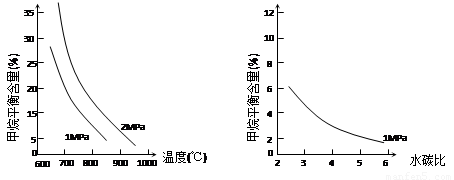
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。
查看习题详情和答案>>