网址:http://m.1010jiajiao.com/timu_id_108580[举报]
一、选择题:(共30分)
一
题号
1
2
3
4
5
6
7
8
答案
D
D
D
B
B
C
C
D
题号
9
10
11
12
13
14
15
答案
A
B
C
B
C
C
A
二、填空题:(共30分)
16、(2分)2PbO?PbO2 ,Pb2(PbO4)或Pb(PbO2)2
17、(3分)CO+PdCl2+H2O==2HCl+Pd+CO2;还原。
18、(3分)(1)燃烧产物中存在CO2;⑵存在;中的澄清石灰水变浑浊。
19、(2分)将肥皂水分别逐滴滴入这四种待测溶液并振荡,根据肥皂水滴入后开始产生泡沫时的不同滴数来区分 。
20、(2分)挥发出来的HCl进入石灰水,与Ca(OH)2作用而阻碍了CO2与Ca(OH)2的作用 (1分) ;CO2与生成的CaCO3作用,生成Ca(HCO3)2 (1分 )。
21、(2分)Si3N4 ;H2SiO3。
22、(6分)⑴用玻璃棒把待测溶液滴在一张pH试纸上,并约一分钟内把试纸显示的颜色跟比色卡对照; ⑵碱;酸。⑶洗发;护发。
23、(6分)
⑴ ① H2S+Na2CO3=NaHCO3+NaHS ;② NaHS+RNO+H2O=S↓+NaOH+RNHOH ;
③ NaOH+Na HCO3=Na2CO3+H2O ;④ 2RNHOH+O2=2RNO+2H2O
⑵ 2H2S+O2=2S↓+2H2O;催化
三、实验题:(共29分)
24、(11分)⑴除去鼓入空气中的二氧化碳;防止空气中的二氧化碳和水进入B中影响实验结果;防止D中的水蒸气进入B中;用除去二氧化碳的空气赶走体系中的二氧化碳;用除去二氧化碳的空气将反应产生的二氧化碳 全部赶入B中; 不能 ,①空气中含少量二氧化碳、②反应后装置中残留二氧化碳均会造成结论偏差。⑵ 43.4 ;95.4% 。
25、(12分) (1) 乙;因为铁是化学性质较活泼的金属,尤其是铁粉颗粒小,常温下更易与空气中的氧气、水蒸气反应而生锈。 (2)
实验步骤
预期的实验现象
结论
①用磁铁充分接触滤纸上的脱氧剂粉末
绝大部分黑色粉末被吸引
脱氧剂的成分是铁粉
②将红色物质放入小试管中,加入足量稀硫酸观察现象。继续滴加足量的NaOH溶液。
红色物质溶解,溶液呈黄棕色,产生红褐色沉淀
红色物质是Fe203
此项可有多种答案,只要原理正确,各项叙述清楚,能确定铁粉及氧化铁的存在,均可给分。
(3) Fe203 + 3H2SO4 = Fe2( SO4 )3十3H2O
Fe2( SO4 )3 + 6NaOH === 2Fe (OH)3↓+3Na2 SO4
26、(6分) 换一根长的导管,并用湿毛巾包住导管,然后再在导管的另一端做点火试验。
⑷导管口同样能点燃,去掉毛巾,导内壁看不到冷凝的固体;
导管口不能点燃,去掉毛巾,导管内壁可看到有冷凝的固体
导管口能点燃,但火焰较小,去掉毛巾,导管内壁能看到冷凝的固体。
⑸2CnH2n+2+(3n+1)O2 点燃 2nCO2+(2n+2) H2O
四、计算题
27、 (l)84.8%,
实验次数
每次产生的CO2的质量(g)
第一次先逐滴加盐酸100g
0
第二次再逐滴加盐酸100g
第三次再逐滴加盐酸100g
②关系图。
.files/image007.gif) CO2
CO2
.files/image008.gif) |
.files/image009.gif)
.files/image010.gif)
.files/image011.gif) 质量/g
质量/g
8.8
0 100 200 300 稀盐酸质量/g
本资料由《七彩教育网》www.7caiedu.cn 提供!
| 编号 项目 |
1 | 2 | 3 | 4 |
| 石料质量/g | 25.0 | 25.0 | 50.0 | 50.0 |
| 稀盐酸质量/g | 120.0 | 150.0 | 250.0 | 100.0 |
| CO2气体质量/g | 8.8 | 8.8 | 18.8 | 8.8 |
(1)表中有一次测定的数据有明显的错误,这次数据的编号是
(2)25.0g石料恰好完全反应时,消耗稀盐酸的质量是
(3)计算该石料中碳酸钙的质量分数.
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.45 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程) 查看习题详情和答案>>
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少?
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生或沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入盛有NaOH溶液的烧杯中,并用温度计测量温度变化.
小军发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低.对此合理的解释是
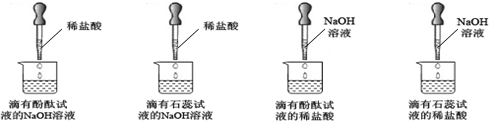
【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小雯同学在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌).
①通过实验现象,小雯排除了实验B,你认为她的理由是
②实验C中溶液的颜色最终变成了红色,但也被排除,原因是
③实验时,老师告诉小雯:相对于实验A,实验D也有不足.通过下面的资料,你认为理由是
【资料卡片】:
紫色石蕊试液和无色酚酞试液在不同酸碱性溶液中的变色情况
| 紫色石蕊试液 | pH<5.0:红色 | 5.0<pH<8.0:紫色 | pH>8.0:蓝色 |
| 无色酚酞试液 | pH<8.2:无色 | 8.2<pH<10.0:红色 | pH>10.0:无色 |
【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:
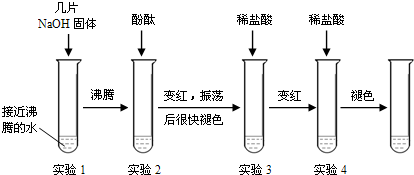
①实验1所得溶液沸腾时的温度
②实验后溶液一定显碱性的试管有
③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识?
(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是
【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小江同学查阅了不同温度下NaOH的溶解度(见资料卡片),并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:
| 温度/°C | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 64 | 85 | 138 | 203 | 285 | 376 |
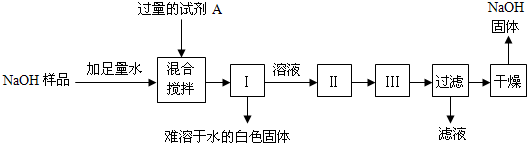
①试剂A是
②操作名称:Ⅰ
③为获得纯度较高的NaOH固体,小江同学应在干燥前将其用
【探究五】:测定NaOH样品中NaOH的质量分数
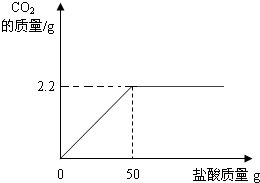
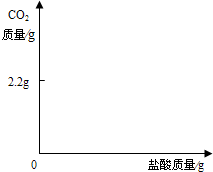
小海取13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收).
求:①样品中NaOH的质量分数(精确到小数点后一位);
②在图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确);解题过程:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 44
xy?7.3%2.2g
| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
| 2.2g |
解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
| 13.5g-5.3g |
| 13.5g |
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 44
xy?7.3%2.2g
| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
| 2.2g |
解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
| 13.5g-5.3g |
| 13.5g |
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:

【反思】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?
【拓展提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?