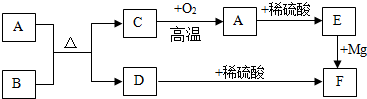
题目内容
(2006?仙桃)为了准确测定校舍建筑工地上石料中碳酸钙的质量分数,该校某化学兴趣小组先将石料粉碎,然后称取4份,分别逐渐加入到4份稀盐酸中(石料中的杂质不参与反应),待反应停止后,所测数据记录如下表:
分析表中数据,回答下列问题:
(1)表中有一次测定的数据有明显的错误,这次数据的编号是
(2)25.0g石料恰好完全反应时,消耗稀盐酸的质量是
(3)计算该石料中碳酸钙的质量分数.
| 编号 项目 |
1 | 2 | 3 | 4 |
| 石料质量/g | 25.0 | 25.0 | 50.0 | 50.0 |
| 稀盐酸质量/g | 120.0 | 150.0 | 250.0 | 100.0 |
| CO2气体质量/g | 8.8 | 8.8 | 18.8 | 8.8 |
(1)表中有一次测定的数据有明显的错误,这次数据的编号是
3
3
.(2)25.0g石料恰好完全反应时,消耗稀盐酸的质量是
100
100
g.(3)计算该石料中碳酸钙的质量分数.
分析:(1)根据第1次和第2次比较计算出25g石料完全反应生成二氧化碳的质量,再根据50g石料产生二氧化碳的质量进行计算;(2)根据第1次实验和第4次实验进行比较进行分析;(3)根据二氧化碳的质量计算出碳酸钙的质量,再用碳酸钙的质量除以样品的质量即可.
解答:解:(1)第1次和第2次实验比较可知25g石料完全反应只能生成8.8g二氧化碳,如果第三次中50g石料完全反应只能生成17.6g,不可能产生18.8g二氧化碳,所以第3次数据错误;
(2)第1次和第2次实验比较可知25g石料完全反应只能生成8.8g二氧化碳,再根据第1次实验和第4次实验进行比较,可知50g石料完全反应生成17.6g二氧化碳,所以第4次是按照100g稀盐酸反应制取8.8g二氧化碳,所以25.0g石料恰好完全反应时,消耗稀盐酸的质量是100g;
(3)解:设石料中CaCO3的质量为X.
由CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
X 8.8g
根据:
=
解得:X=20.0g
故CaCO3的质量分数=
×100%=80.0%
答:石料中CaCO3的质量分数为80.0%.
故答案为:(1)3;(2)100g;(3)80.0%.
(2)第1次和第2次实验比较可知25g石料完全反应只能生成8.8g二氧化碳,再根据第1次实验和第4次实验进行比较,可知50g石料完全反应生成17.6g二氧化碳,所以第4次是按照100g稀盐酸反应制取8.8g二氧化碳,所以25.0g石料恰好完全反应时,消耗稀盐酸的质量是100g;
(3)解:设石料中CaCO3的质量为X.
由CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
X 8.8g
根据:
| 100 |
| 44 |
| x |
| 8.8g |
故CaCO3的质量分数=
| 20g |
| 25g |
答:石料中CaCO3的质量分数为80.0%.
故答案为:(1)3;(2)100g;(3)80.0%.
点评:解答本题关键是根据所给的数据进行比较分析,由相同数和制取的二氧化碳质量相同进行分析.

练习册系列答案
相关题目