摘要:即ρ水gV≥g m≤6.5×65/63 =6.7g答:(略).
网址:http://m.1010jiajiao.com/timu_id_108455[举报]
 19、特快电热壶由于快捷方便,被许多家庭、宾馆使用.请据图示回答:
19、特快电热壶由于快捷方便,被许多家庭、宾馆使用.请据图示回答:(1)制作材料中属于金属或合金的是
①或⑤
(选填一种物质编号,下同),属于有机物的是②(或③、④)
;(2)制作手柄的塑料属于--塑料,(填“热塑性”或“热固性”);
(3)用铜质材料制作电源插头的插脚是利用铜具有
导电
性;(4)这种水壶具有水沸自动断电保护功能,即水沸后因气压增大使电源开关自动断电.分子的角度解释水沸后气压增大的原因:
受热时水分子运动加快,分子间的间隔增大
. 实验室常用氯酸钾与二氧化锰的混合物来制取氧气,二氧化锰能加快氯酸钾的分解,现设计实验证明氧化铜也能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较(即比较反应的快慢).用如图装置进行实验,实验时均以生成25mL气体为准,其他可能影响实验的因素已忽略,相关数据见下表:
实验室常用氯酸钾与二氧化锰的混合物来制取氧气,二氧化锰能加快氯酸钾的分解,现设计实验证明氧化铜也能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较(即比较反应的快慢).用如图装置进行实验,实验时均以生成25mL气体为准,其他可能影响实验的因素已忽略,相关数据见下表:| 实验序号 | KClO3质量 | 催化剂 | 待测数据 |
| ① | 1.2g | 无其他物质 | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
(1)上述实验中的“待测数据”指
生成25mL气体所需的时间
生成25mL气体所需的时间
.(2)本实验装置图中量气装置B由球形干燥管、乳胶管和50mL带刻度玻璃管改造后组装而成,此处所用液体通常选择
A
A
(填字母编号).A、水 B、浓硫酸 C、双氧水 D、无水酒精
(3)若要证明实验②中球形干燥管内收集的气体是O2,可待气体收集结束后,先调整B装置左右液面相平,再用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,
伸入带火星的木条
伸入带火星的木条
,观察现象.(4)为探究CuO在实验②中是否起催化作用,除与实验①比较外,还需补做如下实验(无需写出具体操作):a.证明CuO的质量没有改变;b.
证明CuO的化学性质没有改变
证明CuO的化学性质没有改变
.(5)为证明氧化铜的质量在反应前后没有改变,设计以下实验步骤:
a.准确称量反应前氧化铜的质量;
b.完成实验②;
c.待反应完全后,将实验②反应容器中的物质进行溶解、
过滤
过滤
、洗涤
洗涤
、干燥、称量;d.对比反应前后氧化铜的质量.
某化学兴趣小组采集一些石灰石样品,进行了下列实验:取4份质量不同的石灰石样品,分别与27.0克相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质即不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量.剩余固体的质量与所取样品质量的关系如下表所示:
试计算:(1)石灰石样品中碳酸钙的质量分数.
(2)所用稀盐酸中溶质的质量分数. 查看习题详情和答案>>
| 实验序号 | 石灰石样品质量/g | 稀盐酸的质量/g | 剩余固体质量/g |
| 1 | 1 | 27 | 0.1 |
| 2 | 2 | 27 | 0.2 |
| 3 | 3 | 27 | 0.3 |
| 4 | 4 | 27 | 1.3 |
(2)所用稀盐酸中溶质的质量分数. 查看习题详情和答案>>
(2010?崇左)化学就在我们身边,与我们的生活息息相关.请回答以下生活中的问题:
(1)有机化合物中都含有
(2)新鲜的蔬菜水果中含有的营养素主要是
(3)燃烧需要三个条件:即可燃物、氧气(或空气)和
(4)“沙里淘金”说明黄金在自然界中能够以
(5)水壶内壁上常有水垢(主要成分是碳酸钙和氢氧化镁)沉积,可用食醋除掉.这是因为食醋中含有的乙酸(CH3COOH)具有酸性,可与碳酸钙和氢氧化镁反应.已知乙酸与碳酸钙反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+2H2O,则乙酸与氢氧化镁反应的化学方程式为:
查看习题详情和答案>>
(1)有机化合物中都含有
碳(C)
碳(C)
元素;(2)新鲜的蔬菜水果中含有的营养素主要是
维生素
维生素
和水;(3)燃烧需要三个条件:即可燃物、氧气(或空气)和
达到燃烧所需的最低温度(或着火点)
达到燃烧所需的最低温度(或着火点)
;(4)“沙里淘金”说明黄金在自然界中能够以
单质
单质
(填“单质”或“化合物”)形式存在;(5)水壶内壁上常有水垢(主要成分是碳酸钙和氢氧化镁)沉积,可用食醋除掉.这是因为食醋中含有的乙酸(CH3COOH)具有酸性,可与碳酸钙和氢氧化镁反应.已知乙酸与碳酸钙反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+2H2O,则乙酸与氢氧化镁反应的化学方程式为:
2CH3COOH+Mg(OH)2 =(CH3COO)2Mg+2H2O
2CH3COOH+Mg(OH)2 =(CH3COO)2Mg+2H2O
.我市某校初三化学学习小组的同学前往某地的石灰石矿区进行调查,他们取回矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:
甲组同学:
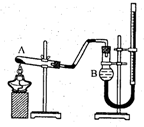
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图1为大理石与稀盐酸反应的反应装置,并测量CO2的体积.(其他仪器省略)
(1)图中左侧的橡皮管的作用
(2)图中装置中油层的作用是
(3)
乙组同学:
【查阅资料】1.氢氧化钠溶液可以吸收二氧化碳气体
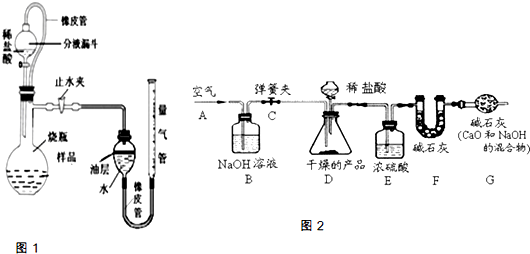
2.碱石灰可以吸收二氧化碳气体和水分取样品,研成粉状后,按图2进行实验.
(1)实验步骤:
①连接好装置,检查气密性; ②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量F的质量; ④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次快速通一段时间空气;⑥称量F的质量,计算前后两次质量差.最后根据CO2的质量求出样品中碳酸钙的质量
(2)问题探究:①产品研成粉的目的
②B装置的作用是
③若没有E装置,则测定的CaCO3的质量分数会
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的
总结反思:(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因
查看习题详情和答案>>
甲组同学:
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图1为大理石与稀盐酸反应的反应装置,并测量CO2的体积.(其他仪器省略)

(1)图中左侧的橡皮管的作用
使分液漏斗和烧瓶内的气压始终保持平衡防止测得气体体积有误差
使分液漏斗和烧瓶内的气压始终保持平衡防止测得气体体积有误差
(2)图中装置中油层的作用是
隔绝CO2和水,防止CO2溶于水并和水反应
隔绝CO2和水,防止CO2溶于水并和水反应
(3)
反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平
反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平
(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.乙组同学:
【查阅资料】1.氢氧化钠溶液可以吸收二氧化碳气体
2.碱石灰可以吸收二氧化碳气体和水分取样品,研成粉状后,按图2进行实验.
(1)实验步骤:
①连接好装置,检查气密性; ②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量F的质量; ④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次快速通一段时间空气;⑥称量F的质量,计算前后两次质量差.最后根据CO2的质量求出样品中碳酸钙的质量
(2)问题探究:①产品研成粉的目的
增大与盐酸的接触面积加快反应速率,使反应进行的更充分
增大与盐酸的接触面积加快反应速率,使反应进行的更充分
;②B装置的作用是
吸收除去空气中的二氧化碳,以免对实验干扰
吸收除去空气中的二氧化碳,以免对实验干扰
;G装置的作用是防止空气中二氧化碳和水份进入F中以免对实验干扰
防止空气中二氧化碳和水份进入F中以免对实验干扰
,③若没有E装置,则测定的CaCO3的质量分数会
偏大
偏大
(填“偏大”、“偏小”、“不变”).④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的
排除装置内空气中二氧化碳气体,使装置中的CO2全部被碱石灰吸收,以免对实验干扰
排除装置内空气中二氧化碳气体,使装置中的CO2全部被碱石灰吸收,以免对实验干扰
总结反思:(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因
二氧化碳溶于水中
二氧化碳溶于水中
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因
步骤⑤中快速通空气使空气中二氧化碳没有吸收完全
步骤⑤中快速通空气使空气中二氧化碳没有吸收完全
.