45.(6分)某同学去溶洞游玩,带回了一些山上的碎石,研究其碳酸钙的含量。取石灰石样品分别与相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质既不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量。剩余固体的质量与所取样品质量的关系如下表所示。
|
实验序号 |
石灰石样品质量/g |
稀盐酸的质量/g |
剩余固体的质量/g |
|
1 |
2.0 |
20.0 |
0.2 |
|
2 |
2.0 |
27.0 |
0.2 |
|
3 |
3.0 |
27.0 |
0.3 |
|
4 |
4.0 |
27.0 |
1.3 |
试计算:(1)石灰石样品中碳酸钙的质量分数;
(2)利用恰好完全反应的一组数据,计算反应后溶液中溶质的质量分数。
顺义区2005-2006学年初三第一次统一练习答案
43.铬(Cr )是一种重要的金属材料,它具有良好的光泽度和抗腐蚀性,常用来镀在其他金属的表面,铬同铁、镍组成的合金可以制成各种性能的不锈钢。某校化学小组对Cr 、Al 、Cu 的金属活动性顺序进行探究,过程如下:
[做出假设]对三种金属的活动性顺序提出可能的假设
(1)Al>Cr>Cu;(2)Al>Cu>Cr
你觉得还有其他的可能性吗?请把它们写出来(有几种写几种,错答、多答扣分)
假设:(3)__________________(4)_____________……
[查阅资料]该小组同学查阅了部分含铬化合物的溶解性如下表:
|
|
OH- |
NO3- |
SO42- |
Cl- |
CO32- |
|
Cr3+ |
不 |
溶 |
溶 |
溶 |
- |
(“-”表示该物质不存在或遇水就分解)且得知铬能与酸反应。
[设计实验]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象。
[控制实验条件]三种金属投入稀盐酸前都先用砂纸将其表面擦光亮,其目的是_________.
A、除去氧化膜,利于直接反应 B、使表面光亮,利于观察现象 C、使金属温度相同,易反应。
[记录现象]
|
金属 |
Cr |
Al |
Cu |
|
与盐酸反应的现象 |
气体产生缓慢 金属逐渐溶解 |
气泡产生激烈 金属迅速溶解 |
|
[得出结论]原假设中正确的是_____(填序号).写出铬与盐酸反应的化学方程式___
[结论应用](1)根据探究结果,请你预测铬与硫酸铜溶液______(填“能”或“不能”)反应,理由是___________。
(2)除该小组的实验设计外,你能否设计一组实验,一次性验证上述假设的正确性,你的设计所用到的一组物质的化学式是________________________(只写出一组既可)
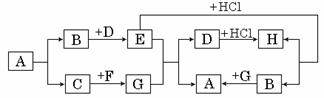 (反应条件和生成产物中的水已略去)。其中A是一种常见的建筑材料,B是一种常见的气体,H是一种含钠的化合物。
(反应条件和生成产物中的水已略去)。其中A是一种常见的建筑材料,B是一种常见的气体,H是一种含钠的化合物。
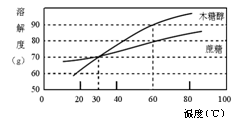 (5分)研究表明,木糖醇是一种理想的蔗糖替代品。它具有甜味足、溶解性好、防龋齿、适合糖尿病患者食用的优点。右图是木糖醇和蔗糖的
(5分)研究表明,木糖醇是一种理想的蔗糖替代品。它具有甜味足、溶解性好、防龋齿、适合糖尿病患者食用的优点。右图是木糖醇和蔗糖的