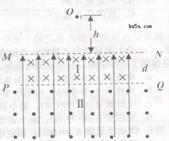
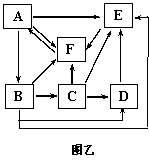
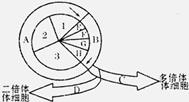
29.Ⅰ.下图甲表示某湖泊生态系统能量流动部分简图,Ⅰ、Ⅱ、Ⅲ代表该生态系统的三个营养级,括号中数值表示一年内的能量转化值(单位:百万千焦/平方米)。图乙表示某生态系统碳循环模式图,A-F表示该生态系统的相关成分。请回答下列问题:(14分)
|




|
|
|
|
|
|
|
|
|
|
|
|
|
(1)若要正确表示图甲所示的湖泊生态系统能量流动情况,图甲中应该补充能量流动情况是 ▲ (用图甲中相应的符号和箭头表示)。
(2)若图甲所示的湖泊生态系统的总面积为10000 m2,则每年流经该生态系统的总能量值是 ▲ 百万千焦。第一、二营养级之间的能量传递效率为 ▲ %(精确到小数点后两位)。
(3)湖泊在受到轻度污染后,能够迅速恢复,这是通过 ▲ 反馈调节机制来实现的。
(4)图乙表示某生态系统中碳循环示意图,在生物群落和无机环境间,碳元素以 ▲ 形式进行循环。请以字母和箭头表示该生态系统中的捕食食物链。 ▲
(5)图乙中的农作物被重金属污染,图中 ▲ 字母代表的生物体内重金属浓度最高。
Ⅱ.桑树的叶子是一种传统中药,桑叶提取液具有降低血糖的作用。为进一步研究桑叶提取液对糖尿病大鼠降低血糖的效果,某研究小组进行了实验。现请你把实验报告补充完整。
材料与药剂:生理状况相同的健康大鼠30只、桑叶提取液、蒸馏水,血糖测定仪等(12分)
(1)实验步骤:
①从上述大鼠中随机取出10只作为甲组,把另20只制备成实验性糖尿病的大鼠,并随机均分成乙组和丙组。
② ▲ 。
③对丙组每只大鼠灌喂桑叶提取液2 mL/ d,连续灌喂4 周;对甲组和乙组的每只大鼠 ▲ 。期间各组大鼠均饲喂普通饲料,自由饮食。
④4周后, ▲ 。
(2)实验结果:
研究结果如下表所示,但未标明组别。请根据上述步骤将“组别”栏补充完整(用甲、乙、丙表示)。
桑叶提取液对实验性糖尿病大鼠血糖的影响
|
组别 |
数量 |
实验开始时(mmol / L) |
给药4周后(mmol /
L) |
|
|
10 |
3.85±1.28 |
3.94±2.20 |
|
|
10 |
18.62±3.08 |
10.12±2.65 |
|
|
10 |
19.46±3.98 |
19.00±2.70 |
(3)实验结论: ▲ 。
27.(14分)某研究性学习小组拟对一块Fe、Al合金做成分鉴定和含量的测定:
选用以下提供的试剂,根据下列流程,设计实验方案,用化学方法验证该合金中含
Fe、Al两种元素:稀盐酸、NaOH溶液、KSCN溶液、3%双氧水溶液。
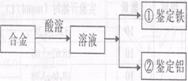 (1)鉴定Fe:取酸溶后的溶
(1)鉴定Fe:取酸溶后的溶
液少量于试管中,滴加3%双氧水
溶液后,再滴加KSCN溶液,写
出反应现象及双氧水参加的反应
的离子方程式___▲___。
(2)请设计鉴定Al的方法:___▲___定量研究:
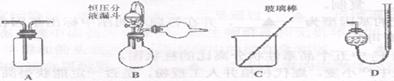
方案I:气体分析法
通过测量试样(m1 g)与碱反应生成的氢气体积来实现探究目标。
(1)选用下图中的B和___▲___ (填仪器标号)两个装置进行实验。
(2)测得充分反应后生成氢气的体积为VL(标准状况),Al的质量分数w (Al)= ___▲___。
(3)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将___▲___ (填“偏大”、
“偏小”或“无影响”)。版权:
方案Ⅱ:差量分析法
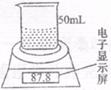 某学生用电子天平和必要的实验仪器测定铁铝合金中各组分的含量,其实验装置如右图所示:
某学生用电子天平和必要的实验仪器测定铁铝合金中各组分的含量,其实验装置如右图所示:
实验时,取一块铁铝合金,将其剪成碎块后全部加入到盛有50.0mL、5.00 mol·L-1 NaOH溶液的烧杯中。试回答下列问题:
(1) 不同时间电子天平的示数如下表所示:
|
实验操作过程 |
时间/min |
电子天平的读数/g |
|
烧杯+NaOH溶液 |
|
80.0 |
|
烧杯+溶液+样品 |
0 |
87.8 |
|
1 |
87.5 |
|
|
2 |
87.3 |
|
|
3 |
87.2 |
|
|
4 |
87.2 |
则合金中铁的质量分数为___▲___ (保留三位有效数字,下同)
(2)上述50.0mLNaOH溶液最多可作用于___▲___g 该铁铝合金样品。
版权:
26.(15分)CCl4、CHCl3、CH2Cl2等跟氟利昂一样,若逸散在空气中对保护臭氧层造成
不利影响。为妥善处理氯甲烷生产企业的副产物CCl4,化学家研究在催化条件下,通过
下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。
CCl4(g)+H2(g)  CHCl3(g)+HCl(g)
CHCl3(g)+HCl(g)
|
实验 序号 |
温度℃ |
初始CCl4浓度 (mol·L-1) |
初始H2浓度 (mol·L-1) |
CCl4的平衡转化率 |
|
1 |
110 |
0.8 |
1.2 |
A |
|
2 |
110 |
1 |
1 |
50% |
|
3 |
100 |
1 |
1 |
B |
1此反应的化学平衡常数表达式为:___▲______,在110℃时平衡常数为___▲____。
②实验1中,CCl4的转化率A___▲____50%(填“大于”、“小于”或等于”)。
③实验2中,10 h时刚好达到平衡,H2的平均反应速率为___▲____。在此实验的平衡
体系中,再加入0.5 mol CCl4和1.0兀mol HCl,平衡将向___▲____方向移动。
④实验3中,B的值___▲____(选填序号)
A.等于50% B.大于50% C. 小于50% D. 从本题资料,无法判断
(2)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应中CCl4的转化率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如下图(图中实线是反应中CCl4转化率的变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。版权:
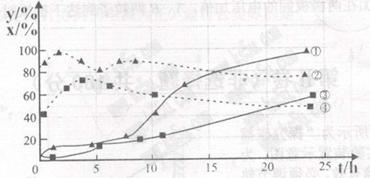
A.在图示四条线中表示H2起始浓度为2 mol·L-1实验的反应中CCl4转化率的变
化曲线是___▲____。
B. 根据上图曲线,氢气的起始浓度为___▲____ mol·L-1时,有利于提高产物中CHCl3
的百分含量。
版权:
 D.在人的一生中,细胞中自由水和结合水的比值逐渐上升
D.在人的一生中,细胞中自由水和结合水的比值逐渐上升 已知: 1CH3CHO+CH3CHO CH3CH-CH2CHO
已知: 1CH3CHO+CH3CHO CH3CH-CH2CHO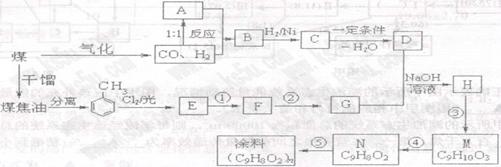
 D+G NaOH溶液 H:___▲___
D+G NaOH溶液 H:___▲___ ,底端经一长度可忽略的光滑
,底端经一长度可忽略的光滑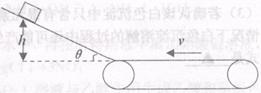 的物体从高h=30cm的斜面上由静止开始下滑,
的物体从高h=30cm的斜面上由静止开始下滑,