摘要:生铁和钢的比较 生铁 钢 主要成分 Fe Fe 含碳量 2-4.3% 0.03-2% 分类 白口铁.灰口铁.球墨铸铁 低碳钢 不锈钢 碳素钢 中碳钢 合金钢 钨钢 高碳钢 锰钢 硅钢 高温 冶炼 原料 铁矿石.焦炭.石灰石 生铁.废钢等 设备 高炉 转炉.电炉.平炉 主要原理 高温条件下.用CO从铁的氧化物中将铁还原出来.如3CO+Fe2O3==2Fe+3CO2 在高温条件下.用O2或铁的氧化物将生铁中过多的C和其它杂质转变为气体或炉渣而除去 力学性能 硬而脆.可铸不可锻 软硬而韧.有弹性.可铸又可锻轧
网址:http://m.1010jiajiao.com/timu3_id_99924[举报]
金属是一种非常重要的资源,在生产、生活中有着广泛的用途。
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
(2)央视3·15晚会曝光某品牌汽车厂为了节约成本,采用价格相对便宜的普通钢板代替防腐性能较好的镀锌板,造成钢板生锈,给车主带来极大安全隐患。普通钢板在空气中锈蚀,实际上是铁跟空气中的 共同作用的结果。
(3)保护金属资源的措施有 (答一条即可)。
(4)亮亮同学用稀盐酸和另一种溶液,验 证了Mg、Fe、Cu、Ag四种金属的活动性顺序是依次减弱的。请回答下列问
证了Mg、Fe、Cu、Ag四种金属的活动性顺序是依次减弱的。请回答下列问 题:
题:
① 亮亮所用的另一种溶液是 。
② 说明Mg比Fe活泼的实 验现象是 。
验现象是 。
③ 说明Cu比Ag活泼的实验现象是 。
查看习题详情和答案>>(2013?大丰市一模)金属是一种非常重要的资源,在生产、生活中有着广泛的用途.
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁.用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为
(2)央视3?15晚会曝光某品牌汽车厂为了节约成本,采用价格相对便宜的普通钢板代替防腐性能较好的镀锌板,造成钢板生锈,给车主带来极大安全隐患.普通钢板在空气中锈蚀,实际上是铁跟空气中的
(3)保护金属资源的措施有
(4)亮亮同学用稀盐酸和另一种溶液,验证了Mg、Fe、Cu、Ag四种金属的活动性顺序是依次减弱的.请回答下列问题:
①亮亮所用的另一种溶液是
②说明Mg比Fe活泼的实验现象是
③说明Cu比Ag活泼的实验现象是
查看习题详情和答案>>
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁.用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(2)央视3?15晚会曝光某品牌汽车厂为了节约成本,采用价格相对便宜的普通钢板代替防腐性能较好的镀锌板,造成钢板生锈,给车主带来极大安全隐患.普通钢板在空气中锈蚀,实际上是铁跟空气中的
氧气、水
氧气、水
共同作用的结果.(3)保护金属资源的措施有
有计划、合理地开采(或寻找代用品;或防止锈蚀;或加强废旧金属的回收再利用)
有计划、合理地开采(或寻找代用品;或防止锈蚀;或加强废旧金属的回收再利用)
(答一条即可).(4)亮亮同学用稀盐酸和另一种溶液,验证了Mg、Fe、Cu、Ag四种金属的活动性顺序是依次减弱的.请回答下列问题:
①亮亮所用的另一种溶液是
硝酸银溶液
硝酸银溶液
.②说明Mg比Fe活泼的实验现象是
与酸反应镁比铁剧烈
与酸反应镁比铁剧烈
.③说明Cu比Ag活泼的实验现象是
无明显现象(或铜丝表面有一层银白色物质生成)
无明显现象(或铜丝表面有一层银白色物质生成)
.人类的生产生活离不开金属材料.
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把一种金属的位置移到最后,则正好符合某种化学规律.这种金属和该化学规律分别是
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属.以下用品中,主要利用金属导热性的是

A铜导线 B不锈钢高压锅 C铝制易拉罐
(3)铜和铁一样也容易生锈,铜锈的主要成分是碱式碳酸铜〔Cu2(OH)2CO3〕,是铜与空气中的氧气、水和
(4)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中
回收铜的过程如下:
蓝色的硫酸铜溶液
固体M
铜
①操作a的名称
②证明N过量选用的试剂是
③向蓝色溶液加入过量铁粉,发生反应的化学方程式是
(5)回收锈蚀钢重新冶炼是保护金属资源的一条有效途径.写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)化学方程式
某炼铁厂现用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁92%的生铁的质量是
查看习题详情和答案>>
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把一种金属的位置移到最后,则正好符合某种化学规律.这种金属和该化学规律分别是
铁
铁
、金属活动性逐渐增强
金属活动性逐渐增强
.(2)铝、铁、铜是我们生产生活中使用比较广泛的金属.以下用品中,主要利用金属导热性的是
B
B
(填序号).
A铜导线 B不锈钢高压锅 C铝制易拉罐
(3)铜和铁一样也容易生锈,铜锈的主要成分是碱式碳酸铜〔Cu2(OH)2CO3〕,是铜与空气中的氧气、水和
CO2
CO2
(填化学式)共同作用的结果.(4)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中
回收铜的过程如下:
蓝色的硫酸铜溶液
| 加入过量的铁粉 |
| 操作a |
| 加入过量的N |
| 操作a |
①操作a的名称
过滤
过滤
.②证明N过量选用的试剂是
铁片
铁片
.③向蓝色溶液加入过量铁粉,发生反应的化学方程式是
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.(5)回收锈蚀钢重新冶炼是保护金属资源的一条有效途径.写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)化学方程式
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
某炼铁厂现用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁92%的生铁的质量是
608.7
608.7
t(计算结果精确到0.1).化学是造福人类的科学,在人体保健、医疗卫生、工农业生产等方面作出了重大贡献,请你用所学的化学知识解答有关问题.
(1)低血糖患者每天都应注意摄入一定量含淀粉的食物,以使血液中维持一定浓度的葡萄糖.请你列举两种富含淀粉的食物
(2)油炸食物不宜多吃,因长时间煎炸会产生有毒物质丙烯醛(C3H4O).丙烯醛在空气中完全燃烧时,生成二氧化碳和水.请写出丙烯醛完全燃烧的化学方程式:
(3)煮水的铝壶内壁上沉积的水垢(主要成分是碳酸钙和氢氧化镁)可以加入适量的稀盐酸把它除掉,用化学方程式表示稀盐酸能“除水垢”和“要适量”的原因:
(4)铝被人类大规模开发、利用的年限比铜和铁晚得多的原因是
①铝的硬度小 ②铝较活泼 ③地壳中铝的含量高 ④铝的表面容易形成致密的保护膜
(5)干粉灭火器中干粉的主要成分是碳酸氢钠(NaHCO3),受热时分解生成碳酸钠、水和二氧化碳,从而达到灭火的目的,该反应的化学方程式为
(6)古代铜币表面绿色铜锈的主要成分是Cu2(OH)2CO3,文物鉴定人员常用酸验法鉴别铜锈真伪:用细玻璃棒蘸取少许稀盐酸,涂擦在需要鉴别可疑铜锈的部位,若有气泡产生则初定为铜锈,反应的化学方程式为
(7)某厂采用联合法生产硫酸铜、硫酸亚铁作饲料添加剂,主要步骤如图所示:
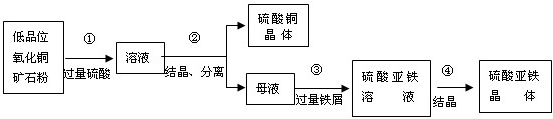
写出上图中①、③反应的化学方程式:
①
③
查看习题详情和答案>>
(1)低血糖患者每天都应注意摄入一定量含淀粉的食物,以使血液中维持一定浓度的葡萄糖.请你列举两种富含淀粉的食物
米饭
米饭
、馒头
馒头
.(2)油炸食物不宜多吃,因长时间煎炸会产生有毒物质丙烯醛(C3H4O).丙烯醛在空气中完全燃烧时,生成二氧化碳和水.请写出丙烯醛完全燃烧的化学方程式:
2C3H4O+7O2
6CO2+4H2O
| ||
2C3H4O+7O2
6CO2+4H2O
.
| ||
(3)煮水的铝壶内壁上沉积的水垢(主要成分是碳酸钙和氢氧化镁)可以加入适量的稀盐酸把它除掉,用化学方程式表示稀盐酸能“除水垢”和“要适量”的原因:
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
、Mg(OH)2+2HCl═MgCl2+2H2O
Mg(OH)2+2HCl═MgCl2+2H2O
、2Al+6HCl═2AlCl3+3H2↑
2Al+6HCl═2AlCl3+3H2↑
.(4)铝被人类大规模开发、利用的年限比铜和铁晚得多的原因是
②
②
;目前铝在多个领域替代易生锈的钢铁,其主要原因是④
④
.(填序号)①铝的硬度小 ②铝较活泼 ③地壳中铝的含量高 ④铝的表面容易形成致密的保护膜
(5)干粉灭火器中干粉的主要成分是碳酸氢钠(NaHCO3),受热时分解生成碳酸钠、水和二氧化碳,从而达到灭火的目的,该反应的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
.
| ||
(6)古代铜币表面绿色铜锈的主要成分是Cu2(OH)2CO3,文物鉴定人员常用酸验法鉴别铜锈真伪:用细玻璃棒蘸取少许稀盐酸,涂擦在需要鉴别可疑铜锈的部位,若有气泡产生则初定为铜锈,反应的化学方程式为
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
.(7)某厂采用联合法生产硫酸铜、硫酸亚铁作饲料添加剂,主要步骤如图所示:

写出上图中①、③反应的化学方程式:
①
CuO+H2SO4═CuSO4+H2O
CuO+H2SO4═CuSO4+H2O
;③
CuSO4+Fe═FeSO4+Cu
CuSO4+Fe═FeSO4+Cu
;Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.