题目内容
化学是造福人类的科学,在人体保健、医疗卫生、工农业生产等方面作出了重大贡献,请你用所学的化学知识解答有关问题.
(1)低血糖患者每天都应注意摄入一定量含淀粉的食物,以使血液中维持一定浓度的葡萄糖.请你列举两种富含淀粉的食物
(2)油炸食物不宜多吃,因长时间煎炸会产生有毒物质丙烯醛(C3H4O).丙烯醛在空气中完全燃烧时,生成二氧化碳和水.请写出丙烯醛完全燃烧的化学方程式:
(3)煮水的铝壶内壁上沉积的水垢(主要成分是碳酸钙和氢氧化镁)可以加入适量的稀盐酸把它除掉,用化学方程式表示稀盐酸能“除水垢”和“要适量”的原因:
(4)铝被人类大规模开发、利用的年限比铜和铁晚得多的原因是
①铝的硬度小 ②铝较活泼 ③地壳中铝的含量高 ④铝的表面容易形成致密的保护膜
(5)干粉灭火器中干粉的主要成分是碳酸氢钠(NaHCO3),受热时分解生成碳酸钠、水和二氧化碳,从而达到灭火的目的,该反应的化学方程式为
(6)古代铜币表面绿色铜锈的主要成分是Cu2(OH)2CO3,文物鉴定人员常用酸验法鉴别铜锈真伪:用细玻璃棒蘸取少许稀盐酸,涂擦在需要鉴别可疑铜锈的部位,若有气泡产生则初定为铜锈,反应的化学方程式为
(7)某厂采用联合法生产硫酸铜、硫酸亚铁作饲料添加剂,主要步骤如图所示:
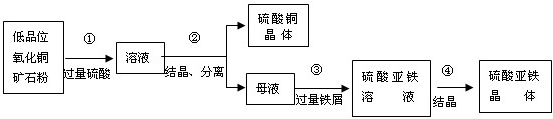
写出上图中①、③反应的化学方程式:
①
③
(1)低血糖患者每天都应注意摄入一定量含淀粉的食物,以使血液中维持一定浓度的葡萄糖.请你列举两种富含淀粉的食物
米饭
米饭
、馒头
馒头
.(2)油炸食物不宜多吃,因长时间煎炸会产生有毒物质丙烯醛(C3H4O).丙烯醛在空气中完全燃烧时,生成二氧化碳和水.请写出丙烯醛完全燃烧的化学方程式:
2C3H4O+7O2
6CO2+4H2O
| ||
2C3H4O+7O2
6CO2+4H2O
.
| ||
(3)煮水的铝壶内壁上沉积的水垢(主要成分是碳酸钙和氢氧化镁)可以加入适量的稀盐酸把它除掉,用化学方程式表示稀盐酸能“除水垢”和“要适量”的原因:
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
、Mg(OH)2+2HCl═MgCl2+2H2O
Mg(OH)2+2HCl═MgCl2+2H2O
、2Al+6HCl═2AlCl3+3H2↑
2Al+6HCl═2AlCl3+3H2↑
.(4)铝被人类大规模开发、利用的年限比铜和铁晚得多的原因是
②
②
;目前铝在多个领域替代易生锈的钢铁,其主要原因是④
④
.(填序号)①铝的硬度小 ②铝较活泼 ③地壳中铝的含量高 ④铝的表面容易形成致密的保护膜
(5)干粉灭火器中干粉的主要成分是碳酸氢钠(NaHCO3),受热时分解生成碳酸钠、水和二氧化碳,从而达到灭火的目的,该反应的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
.
| ||
(6)古代铜币表面绿色铜锈的主要成分是Cu2(OH)2CO3,文物鉴定人员常用酸验法鉴别铜锈真伪:用细玻璃棒蘸取少许稀盐酸,涂擦在需要鉴别可疑铜锈的部位,若有气泡产生则初定为铜锈,反应的化学方程式为
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
.(7)某厂采用联合法生产硫酸铜、硫酸亚铁作饲料添加剂,主要步骤如图所示:

写出上图中①、③反应的化学方程式:
①
CuO+H2SO4═CuSO4+H2O
CuO+H2SO4═CuSO4+H2O
;③
CuSO4+Fe═FeSO4+Cu
CuSO4+Fe═FeSO4+Cu
;Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.分析:(1)可以根据食物中的物质组成方面进行分析、判断,从而得出正确的结论;
(2)根据题目中的信息“丙烯醛在空气中完全燃烧时生成二氧化碳和水”,可得此反应的反应物、生成物及反应条件,然后根据质量守恒定律配平;
(3)用盐酸除水垢是由于盐酸能将不溶性的碳酸钙和氢氧化镁通过化学反应转化成可溶性物质;若盐酸过量,盐酸除去水垢后剩余的盐酸还会与构成铝壶的金属铝反应,会破坏铝壶;
(4)根据铝的活动性比铜、铁强以及铝与氧气反应生成氧化铝的特点分析;
(5)根据题意干粉的主要成分是碳酸氢钠(NaHCO3),它受热后生成碳酸钠、水和二氧化碳,据此写出反应的化学方程式即可;
(6)依据铜锈的主要成分是碱式碳酸铜,结合题干中的现象生成的气体即为二氧化碳,同时有水和氯化铜生成;(7)依据步骤中提供的物质情况,结合具体的关于物质的反应规律书写方程式即可.①氧化铜与硫酸反应会生成硫酸铜与水③母液中含有剩余的硫酸一定量的硫酸铜它们都能与铁置换反应.
(2)根据题目中的信息“丙烯醛在空气中完全燃烧时生成二氧化碳和水”,可得此反应的反应物、生成物及反应条件,然后根据质量守恒定律配平;
(3)用盐酸除水垢是由于盐酸能将不溶性的碳酸钙和氢氧化镁通过化学反应转化成可溶性物质;若盐酸过量,盐酸除去水垢后剩余的盐酸还会与构成铝壶的金属铝反应,会破坏铝壶;
(4)根据铝的活动性比铜、铁强以及铝与氧气反应生成氧化铝的特点分析;
(5)根据题意干粉的主要成分是碳酸氢钠(NaHCO3),它受热后生成碳酸钠、水和二氧化碳,据此写出反应的化学方程式即可;
(6)依据铜锈的主要成分是碱式碳酸铜,结合题干中的现象生成的气体即为二氧化碳,同时有水和氯化铜生成;(7)依据步骤中提供的物质情况,结合具体的关于物质的反应规律书写方程式即可.①氧化铜与硫酸反应会生成硫酸铜与水③母液中含有剩余的硫酸一定量的硫酸铜它们都能与铁置换反应.
解答:解:(1)米饭、馒头等物质中含有丰富的淀粉,故答案为:米饭、馒头;
(2)根据题目中的信息“丙烯醛在空气中完全燃烧时生成二氧化碳和水”,可得此反应的反应物是丙烯醛和氧气,生成物是二氧化碳和水,反应条件是点燃,利用观察法配平,故答案为:2C3H4O+7O2
6CO2+4H2O;
(3)盐酸与水垢中的碳酸钙反应生成氯化钙、水和二氧化碳,该反应的化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O;盐酸与水垢中的氢氧化镁反应生成氯化镁和水,该反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O.
因此水垢可以用盐酸除去;盐酸与铝反应生成氯化铝和氢气,该反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑,因此加入的盐酸要适量.故答案为:CaCO3+2HCl═CaCl2+CO2↑+H2O;Mg(OH)2+2HCl═MgCl2+2H2O;2Al+6HCl═2AlCl3+3H2↑;
(4)由于铝的活动性大于铜、铁的活动性,冶炼的难度大,所以,铝的利用比铜和铁晚得多;由于铝易与氧气反应在铝的表面生成致密氧化铝的保护膜,更耐腐蚀,所以,目前铝在多个领域替代易生锈的钢铁,故答案为:②④;
(5)碳酸氢钠(NaHCO3),它受热后生成纯碱(Na2CO3)、水和二氧化碳,反应的化学方程式为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(6)碱式碳酸铜与盐酸反应会生成氯化铜、水及二氧化碳,结合化学方程式的书写要求完成,故答案为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑;
(7)①氧化铜与硫酸反应会生成硫酸铜与水;③由于母液中含有剩余的硫酸及硫酸铜溶液,所以该过程含有两步反应:与硫酸发生置换反应生成氢气,与硫酸铜发生反应生成铜与硫酸亚铁,故答案为:①CuO+H2SO4=CuSO4+H2O;③CuSO4+Fe=FeSO4+Cu;H2SO4+Fe=FeSO4+H2↑
(2)根据题目中的信息“丙烯醛在空气中完全燃烧时生成二氧化碳和水”,可得此反应的反应物是丙烯醛和氧气,生成物是二氧化碳和水,反应条件是点燃,利用观察法配平,故答案为:2C3H4O+7O2
| ||
(3)盐酸与水垢中的碳酸钙反应生成氯化钙、水和二氧化碳,该反应的化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O;盐酸与水垢中的氢氧化镁反应生成氯化镁和水,该反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O.
因此水垢可以用盐酸除去;盐酸与铝反应生成氯化铝和氢气,该反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑,因此加入的盐酸要适量.故答案为:CaCO3+2HCl═CaCl2+CO2↑+H2O;Mg(OH)2+2HCl═MgCl2+2H2O;2Al+6HCl═2AlCl3+3H2↑;
(4)由于铝的活动性大于铜、铁的活动性,冶炼的难度大,所以,铝的利用比铜和铁晚得多;由于铝易与氧气反应在铝的表面生成致密氧化铝的保护膜,更耐腐蚀,所以,目前铝在多个领域替代易生锈的钢铁,故答案为:②④;
(5)碳酸氢钠(NaHCO3),它受热后生成纯碱(Na2CO3)、水和二氧化碳,反应的化学方程式为:2NaHCO3
| ||
| ||
(6)碱式碳酸铜与盐酸反应会生成氯化铜、水及二氧化碳,结合化学方程式的书写要求完成,故答案为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑;
(7)①氧化铜与硫酸反应会生成硫酸铜与水;③由于母液中含有剩余的硫酸及硫酸铜溶液,所以该过程含有两步反应:与硫酸发生置换反应生成氢气,与硫酸铜发生反应生成铜与硫酸亚铁,故答案为:①CuO+H2SO4=CuSO4+H2O;③CuSO4+Fe=FeSO4+Cu;H2SO4+Fe=FeSO4+H2↑
点评:本题考查营养素、金属及酸的化学性质以及物质的相互转化制备等化学知识,难度不大,只有认真分析,就能做对.

练习册系列答案
相关题目