摘要:在2H2O2=2H2O+O2反应中.反应前后发生改变的微粒是 .生成的新的微粒是 .在此反应中 微粒没有改变.
网址:http://m.1010jiajiao.com/timu3_id_99466[举报]
在实验室用高锰酸钾固体制取氧气的研究中,老师为志强同学提供了如图1下列仪器(导管、橡皮塞等已省略),请你帮他完成相关实验内容.
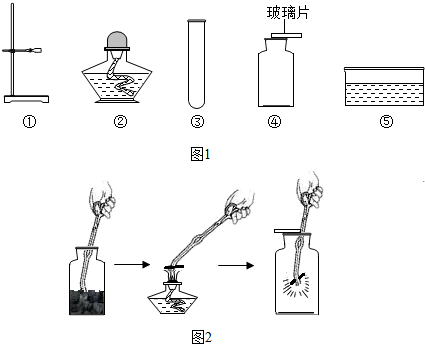
(1)志强为了制取一瓶干燥的氧气,他应该选用的仪器有:
(2)向制取气装置内加入药品前,他应该进行的操作是
(3)志强同学认为,在不改变发生装置的前提下,他还可以选用
(4)实验室还可以用红砖粉末与一种液体试剂混合制氧气,该反应的化学方程式为
(5)图2是木炭在氧气中燃烧的实验图:验证燃烧产物的方法:
查看习题详情和答案>>

(1)志强为了制取一瓶干燥的氧气,他应该选用的仪器有:
①②③④
①②③④
(填编号),该反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,此处收集气体的方法为
| ||
向上排空气法
向上排空气法
;(2)向制取气装置内加入药品前,他应该进行的操作是
气密性检查
气密性检查
,其具体操作步骤是:导气管一端放入水中,用手紧握试管,观察水中有没有气泡冒出
导气管一端放入水中,用手紧握试管,观察水中有没有气泡冒出
;(3)志强同学认为,在不改变发生装置的前提下,他还可以选用
氯酸钾
氯酸钾
(填反应物名称)与二氧化锰来制取氧气,其反应的化学方程式为2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;
| ||
| △ |
(4)实验室还可以用红砖粉末与一种液体试剂混合制氧气,该反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
(5)图2是木炭在氧气中燃烧的实验图:验证燃烧产物的方法:
向实验后的集气瓶中加入澄清石灰水,振荡,液体变浑浊
向实验后的集气瓶中加入澄清石灰水,振荡,液体变浑浊
.实验室常用下列装置制取有关气体.
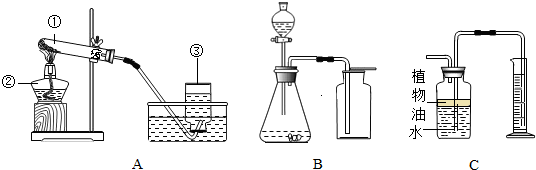
(1)用A装置来KMnO4固体制取O2,该发生装置还可以做我们学过的铜绿分解实验,写出这个反应的化学方程式:
(2)C装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是
(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:
(4)实验室里还可采用B图装置,通过用MnO2作催化剂分解过氧化氢(H202)的方法制取氧气.写出该反应的化学方程式:
(5)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H2O2溶液的试管中,加入a克MnO2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H2O2溶液的试管中,加入a克Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO2和a克Fe2O3.
问题:(1)MnO2和Fe2O3是上述反应中的
(2)实验②,③中的H2O2的浓度(ω%)以
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
问题:(3)从上表中能得出哪些结论?
(6)[提出问题]小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
[猜想]水泥块能作过氧化氢分解的催化剂.
[实验验证]
[结论]水泥块能加快过氧化氢的分解速率,故水泥起能作过氧化氢的催化剂.
[讨论与反思]小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究
[实验步骤]①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,
[分析]如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究
查看习题详情和答案>>

(1)用A装置来KMnO4固体制取O2,该发生装置还可以做我们学过的铜绿分解实验,写出这个反应的化学方程式:
Cu2(OH)2CO3
2CuO+H2O+CO2↑
| ||
Cu2(OH)2CO3
2CuO+H2O+CO2↑
| ||
(2)C装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是
防止二氧化碳和水反应
防止二氧化碳和水反应
,植物油上方原有的空气对实验的结果没有
没有
(填“有”或“没有”)明显影响.(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:
利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大
利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大
.(4)实验室里还可采用B图装置,通过用MnO2作催化剂分解过氧化氢(H202)的方法制取氧气.写出该反应的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
| ||
(5)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H2O2溶液的试管中,加入a克MnO2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H2O2溶液的试管中,加入a克Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO2和a克Fe2O3.
问题:(1)MnO2和Fe2O3是上述反应中的
催化
催化
剂.(2)实验②,③中的H2O2的浓度(ω%)以
5%
5%
为宜.研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
浓度 时间(min) 条件 |
30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| a克MnO2 | 0.2 | 0.8 | 2.0 |
| a克Fe2O3 | 7.0 | 9.0 | 16.0 |
相同条件下,MnO2的催化效果比Fe2O3好
相同条件下,MnO2的催化效果比Fe2O3好
、在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
(至少写两点)(6)[提出问题]小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
[猜想]水泥块能作过氧化氢分解的催化剂.
[实验验证]
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 往盛有过氧化氢溶液的试管中,伸入带火星的木条 往盛有过氧化氢溶液的试管中,伸入带火星的木条 |
木条不复燃 | 常温下过氧化氢溶液不分解 |
| 实验二 | 在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 | 木条复燃 |
过氧化氢溶液在水泥块的作用下能够分解产生氧气 过氧化氢溶液在水泥块的作用下能够分解产生氧气 |
[讨论与反思]小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究
水泥块的质量在反应前后是否改变
水泥块的质量在反应前后是否改变
.[实验步骤]①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,
干燥
干燥
,准确称量水泥块的质量
准确称量水泥块的质量
④对比反应前后水泥块的质量.[分析]如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究
水泥块的化学性质是否改变
水泥块的化学性质是否改变
.在用过氧化氢制氧气时,在过氧化氢溶液中加入少量二氧化锰,过氧化氢立即分解产生气泡.在反应前后,二氧化锰的
查看习题详情和答案>>
质量
质量
和化学性质
化学性质
都不发生改变,它是这一反应的催化
催化
剂.写出该反应的化学表达式2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.该反应属于
| ||
分解
分解
反应.根据下列实验装置图回答
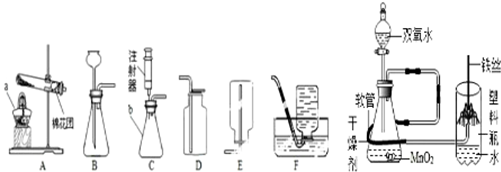
(1)写出标号仪器的名称a
(2)实验室用高锰酸钾制取氧气,应选用的发生装置是
(3)实验室也可以选用装置B中制取O2,反应的符号表达式为
(4)在通常状况下,甲烷是一种无色、无味的气体,密度比空气小,难溶于水.实验室通常用无水醋酸钠固体和碱石灰共热制取甲烷.则实验室制取甲烷气体的发生装置可选用
(5)如图是“铁丝在氧气中燃烧”实验的改进装置.实验时,打开分液漏斗活塞,通入干燥氧气约10秒,引燃铁丝下端火柴杆,伸入塑料瓶内,并对准玻璃管口正上方,观察到的现象是:铁丝剧烈燃烧,
反应的符号表达式为
1.氧气无需提前制备和收集,操作更方便
2.塑料瓶代替集气瓶,防止集气瓶炸裂,更安全
3.装置集氧气的制取、干燥和性质验证于一体,实验更优化
(6)某兴趣小组同学将带火星的木条伸入到收集满氧气的集气瓶内,木条复燃,拿出木条,盖好集气瓶,过一会儿,再用带火星的木条伸入瓶内,木条仍然复燃.重复以上操作,直到木条不再复燃.据此现象你能得到有结论是
查看习题详情和答案>>

(1)写出标号仪器的名称a
酒精灯
酒精灯
、b锥形瓶
锥形瓶
(2)实验室用高锰酸钾制取氧气,应选用的发生装置是
A
A
(填字母代号,下同).收集装置可选用D或F
D或F
,反应的符号表达式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.实验中在试管口放一团棉花的目的是
| ||
防止加热过程中高锰酸钾进入试管
防止加热过程中高锰酸钾进入试管
.(3)实验室也可以选用装置B中制取O2,反应的符号表达式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.若选用C做发生装置,与装置B比较,装置C的优点是
| ||
可控制反应的发生和停止
可控制反应的发生和停止
.(4)在通常状况下,甲烷是一种无色、无味的气体,密度比空气小,难溶于水.实验室通常用无水醋酸钠固体和碱石灰共热制取甲烷.则实验室制取甲烷气体的发生装置可选用
A
A
;收集装置可选用E或F
E或F
.(5)如图是“铁丝在氧气中燃烧”实验的改进装置.实验时,打开分液漏斗活塞,通入干燥氧气约10秒,引燃铁丝下端火柴杆,伸入塑料瓶内,并对准玻璃管口正上方,观察到的现象是:铁丝剧烈燃烧,
火星四射,放出大量的热,生成黑色固体
火星四射,放出大量的热,生成黑色固体
.反应的符号表达式为
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.改进后的优点是
| ||
1、2、3
1、2、3
(填序号) 1.氧气无需提前制备和收集,操作更方便
2.塑料瓶代替集气瓶,防止集气瓶炸裂,更安全
3.装置集氧气的制取、干燥和性质验证于一体,实验更优化
(6)某兴趣小组同学将带火星的木条伸入到收集满氧气的集气瓶内,木条复燃,拿出木条,盖好集气瓶,过一会儿,再用带火星的木条伸入瓶内,木条仍然复燃.重复以上操作,直到木条不再复燃.据此现象你能得到有结论是
带火星的木条是否复燃与氧气的浓度有关
带火星的木条是否复燃与氧气的浓度有关
.学习了MnO2对过氧化氢有催化作用的知识后.某同学想:能否起到类似MnO2的催化剂作用呢?于是进行了如下探究.
【猜想】Ⅰ.Fe2O3不是催化剂、也不参与反应,反应前后质量和化
学性质不变;
Ⅱ.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.Fe2O3是反应的催化剂,反应前后
【实验】用天平称量m1g Fe2O3,取5mL5%的过氧化氢溶液于试管中,进行图15所示实验:
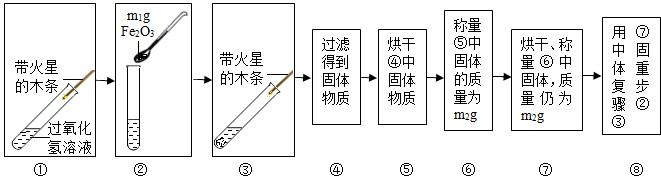
(1)回答下表中问题:
(2)步骤
(3)步骤⑧的目的是
(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为
查看习题详情和答案>>
【猜想】Ⅰ.Fe2O3不是催化剂、也不参与反应,反应前后质量和化
学性质不变;
Ⅱ.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.Fe2O3是反应的催化剂,反应前后
质量和化学性质不变
质量和化学性质不变
.【实验】用天平称量m1g Fe2O3,取5mL5%的过氧化氢溶液于试管中,进行图15所示实验:

(1)回答下表中问题:
| 步骤③的现象 | 步骤⑥、⑦的结果 | 步骤⑧的现象 | 结论 |
| A. 有气泡冒出 有气泡冒出 ;多余空 多余空 B.带火星的木条复燃. |
m2 等于 等于 m1(填“大于”、小于“或”等于“”) |
A.溶液中有气泡放出; B. 带火星的木条复燃 带火星的木条复燃 . |
猜想ⅠⅡ不成立; 猜想Ⅲ成立. |
①
①
(填序号)的目的是证明Fe2O3能加快过氧化氢溶液分解的速率.(3)步骤⑧的目的是
氧化铜的化学性质在反应前后没有发生改变
氧化铜的化学性质在反应前后没有发生改变
.(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为
2H2O2
2H2O+O2↑.
| ||
2H2O2
2H2O+O2↑.
.
| ||