题目内容
学习了MnO2对过氧化氢有催化作用的知识后.某同学想:能否起到类似MnO2的催化剂作用呢?于是进行了如下探究.
【猜想】Ⅰ.Fe2O3不是催化剂、也不参与反应,反应前后质量和化
学性质不变;
Ⅱ.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.Fe2O3是反应的催化剂,反应前后
【实验】用天平称量m1g Fe2O3,取5mL5%的过氧化氢溶液于试管中,进行图15所示实验:
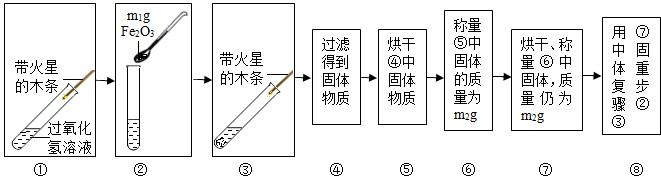
(1)回答下表中问题:
(2)步骤
(3)步骤⑧的目的是
(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为
【猜想】Ⅰ.Fe2O3不是催化剂、也不参与反应,反应前后质量和化
学性质不变;
Ⅱ.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.Fe2O3是反应的催化剂,反应前后
质量和化学性质不变
质量和化学性质不变
.【实验】用天平称量m1g Fe2O3,取5mL5%的过氧化氢溶液于试管中,进行图15所示实验:

(1)回答下表中问题:
| 步骤③的现象 | 步骤⑥、⑦的结果 | 步骤⑧的现象 | 结论 |
| A. 有气泡冒出 有气泡冒出 ;多余空 多余空 B.带火星的木条复燃. |
m2 等于 等于 m1(填“大于”、小于“或”等于“”) |
A.溶液中有气泡放出; B. 带火星的木条复燃 带火星的木条复燃 . |
猜想ⅠⅡ不成立; 猜想Ⅲ成立. |
①
①
(填序号)的目的是证明Fe2O3能加快过氧化氢溶液分解的速率.(3)步骤⑧的目的是
氧化铜的化学性质在反应前后没有发生改变
氧化铜的化学性质在反应前后没有发生改变
.(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为
2H2O2
2H2O+O2↑.
| ||
2H2O2
2H2O+O2↑.
.
| ||
分析:Ⅲ、根据催化剂的定义回答.
(1)根据氧化铁对过氧化氢的分解有催化作用回答③现象;根据催化剂的定义和特点回答⑥⑦结果;根据催化剂的定义和特点回答⑧现象.
(2)根据对比实验的探究方法回答.
(3)根据实验的步骤分析催化剂的有关性质.
(4)根据信息结合化学方程式的书写分析.
(1)根据氧化铁对过氧化氢的分解有催化作用回答③现象;根据催化剂的定义和特点回答⑥⑦结果;根据催化剂的定义和特点回答⑧现象.
(2)根据对比实验的探究方法回答.
(3)根据实验的步骤分析催化剂的有关性质.
(4)根据信息结合化学方程式的书写分析.
解答:解:Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变;
(1)氧化铁对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铁的质量仍为m1g,即步骤⑥、⑦的结果中的m1g=m2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以步骤⑧的现象是溶液中有气泡放出,带火星的木条复燃.
(2)为了看氧化铁是否能改变反应的速率,要通过加入氧化铁与不加氧化铁的现象进行对比,才能得出科学合理的结论,所以步骤①的目的是证明Fe2O3能加快过氧化氢溶液分解的速率.
(3)步骤⑧的目的是证明氧化铜的化学性质在反应前后没有发生改变.
(4)反应物是过氧化氢,催化剂是Fe2O3,生成物是水和氧气,化学方程式是:2H2O2
2H2O+O2↑,其中催化剂是Fe2O3.
故答案为:(1)
(2)①.
(3)氧化铜的化学性质在反应前后没有发生改变.
(4)2H2O2
2H2O+O2↑.
(1)氧化铁对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铁的质量仍为m1g,即步骤⑥、⑦的结果中的m1g=m2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以步骤⑧的现象是溶液中有气泡放出,带火星的木条复燃.
(2)为了看氧化铁是否能改变反应的速率,要通过加入氧化铁与不加氧化铁的现象进行对比,才能得出科学合理的结论,所以步骤①的目的是证明Fe2O3能加快过氧化氢溶液分解的速率.
(3)步骤⑧的目的是证明氧化铜的化学性质在反应前后没有发生改变.
(4)反应物是过氧化氢,催化剂是Fe2O3,生成物是水和氧气,化学方程式是:2H2O2
| ||
故答案为:(1)
| 步骤③的现象 | 步骤⑥、⑦的结果 | 步骤⑧的现象 | 结论 |
| A. 有气泡; B.带火星的木条复燃. |
m2 等于m1 (填“大于”、小于“或”等于“”) |
A.溶液中有气泡放出; B. 带火星的木条复燃. |
猜想ⅠⅡ不成立; 猜想Ⅲ成立. |
(3)氧化铜的化学性质在反应前后没有发生改变.
(4)2H2O2
| ||
点评:催化剂、催化作用是初中重要基本概念之一,是考查的重点和热点,主要考查对催化剂、催化作用概念的理解,对催化效率影响因素的探究等.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目