摘要:二氧化硫是一种大气污染物.溶于水所得溶液的 7(填“大于 或“小于 或“等于 ).二氧化硫气体能被氢氧化钠溶液吸收.请写出该反应的化学方程式 .
网址:http://m.1010jiajiao.com/timu3_id_97267[举报]
27、二氧化硫是一种无色有刺激性气味的气体,是严重污染空气的气体之一,同时它也是工业上制取硫酸的中间产物.
1)硫磺在空气中燃烧的现象是:
(2)二氧化硫易溶于水,还能与水反应生成相应的酸,所以其水溶液显
方法一__
方法二
反应的化学方程式是
(3)二氧化硫在空气中尘埃的作用下,会与氧气反应产生三氧化硫,三氧化硫在和水反应生成硫酸.尘埃在此起的作用是
(4)用石灰浆可以较好的吸收二氧化硫气体,能有效的降低其对空气的污染.反应的化学方程式
查看习题详情和答案>>
1)硫磺在空气中燃烧的现象是:
发出微弱的淡蓝色火焰
_;在氧气中燃烧的现象是:发出明亮的蓝紫色火焰
;通过这一组实验你能获得的信息是(任写一条)氧气的浓度越大,反应越剧烈
.反应的化学方程式是S+O2=SO2
.(2)二氧化硫易溶于水,还能与水反应生成相应的酸,所以其水溶液显
酸
,请你设计实验检验溶液的酸性,你的主要操作过程和实验现象与结论是(两种方法)方法一__
用玻璃棒蘸取少量液体滴在pH试纸上,和比色卡对照,pH小于7,证明溶液显酸性
;方法二
取少量液体于试管中,滴尘埃几滴紫色石蕊试液,变红色,证明溶液显酸性
.反应的化学方程式是
SO2+H2O=H2SO3
(3)二氧化硫在空气中尘埃的作用下,会与氧气反应产生三氧化硫,三氧化硫在和水反应生成硫酸.尘埃在此起的作用是
催化作用
;发生的两个化学反应方程式是2SO2+O2=2SO3;SO3+H2O=H2SO4
.(4)用石灰浆可以较好的吸收二氧化硫气体,能有效的降低其对空气的污染.反应的化学方程式
SO2+Ca(OH)2=CaSO3+H2O
.化学是一门以实验为基础的科学.
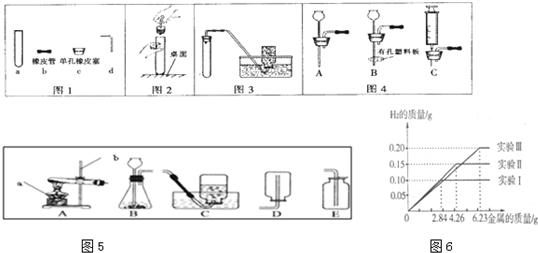
(1)根据图1回答:①写出a的名称
(2)采用图2所示操作可能造成的后果之一是
(3)利用图3装置(夹持装置未画出)能进行的实验是
(4)图3中的气体发生装置虽然简单,操作方便,但无法控制反应速率.请从图4中选取
(5)实验室用图5中A装置制氧气的化学方程式是
(6)机动车排放的尾气是空气的重要污染源,其成分之一是NO.某化学兴趣小组的同学在查阅资料后得知:①NO常温下是一种无色、难溶于水的气体,它的密度比空气略大;②NO常温下能与氧气迅速反应,生成红棕色的NO2气体:2NO2+O2═2NO2;③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4X. 根据以上信息完成下列问题:
①物质X的化学式为
②若选择合适的装置来制取并收集NO气体,你选择图5中的发生装置是
③该小组的同学通过查阅资料还得知:a.NO容易和血红蛋白结合而使人中毒;b.NO能抗击侵入人体的微生物,并能阻止癌细胞的繁殖和肿瘤细胞的扩散.综合分析①和②的信息,你得到的启示是
④某化工厂准备生产Cu(NO3)2,以铜和稀硝酸为主要原料设计了两种方案:
方案一:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑十4X;
方案二:2Cu+O2
2CuO,CuO+2HNO3═Cu(NO3)2+H2O.从环境保护的角度考虑,你认为较合理的方案是
(7)某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象图6:试回答(计算结果精确到0.1%):
①写出实验中有关的化学方程式:
②实验I中铁参加反应的质量为
③稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少.
查看习题详情和答案>>

(1)根据图1回答:①写出a的名称
试管
试管
;②在连接c和d时,使d较易插入c中的措施是用水湿润
用水湿润
;(2)采用图2所示操作可能造成的后果之一是
试管破裂
试管破裂
;(3)利用图3装置(夹持装置未画出)能进行的实验是
CD
CD
(选填序号);A.用高锰酸钾制氧气; B.用石灰石与稀盐酸制二氧化碳;C.用锌与稀硫酸制氢气; D.用双氧水与二氧化锰制氧气.(4)图3中的气体发生装置虽然简单,操作方便,但无法控制反应速率.请从图4中选取
B或C
B或C
(选填序号)与图1中a组装成新的气体发生装置,以达到控制反应速率的目的.(5)实验室用图5中A装置制氧气的化学方程式是
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
,反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是
| ||
| △ |
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,黑色粉末在反应中的作用是
| ||
催化
催化
.用E装置收集氧气的依据是氧气的密度大于空气的密度
氧气的密度大于空气的密度
,检验氧气是否集满的方法是将带火星的木条放在集气瓶口,木条复燃说明已满
将带火星的木条放在集气瓶口,木条复燃说明已满
.(6)机动车排放的尾气是空气的重要污染源,其成分之一是NO.某化学兴趣小组的同学在查阅资料后得知:①NO常温下是一种无色、难溶于水的气体,它的密度比空气略大;②NO常温下能与氧气迅速反应,生成红棕色的NO2气体:2NO2+O2═2NO2;③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4X. 根据以上信息完成下列问题:
①物质X的化学式为
H2O
H2O
. ②若选择合适的装置来制取并收集NO气体,你选择图5中的发生装置是
B
B
,收集装置是C
C
.③该小组的同学通过查阅资料还得知:a.NO容易和血红蛋白结合而使人中毒;b.NO能抗击侵入人体的微生物,并能阻止癌细胞的繁殖和肿瘤细胞的扩散.综合分析①和②的信息,你得到的启示是
任何物质都具有两面性
任何物质都具有两面性
④某化工厂准备生产Cu(NO3)2,以铜和稀硝酸为主要原料设计了两种方案:
方案一:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑十4X;
方案二:2Cu+O2
| ||
方案二
方案二
.从经济角度考虑选择此方案的理由是产生相同质量的硝酸铜所消耗的稀硝酸少
产生相同质量的硝酸铜所消耗的稀硝酸少
.(7)某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象图6:试回答(计算结果精确到0.1%):
①写出实验中有关的化学方程式:
Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.②实验I中铁参加反应的质量为
2.8g
2.8g
.③稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少.
化学是一门以实验为基础的科学.
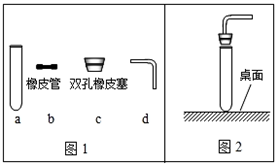

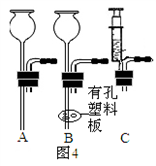

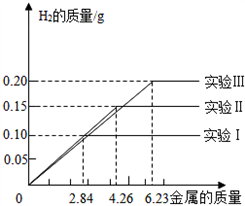
图6
(1)根据图1回答:①写出a的名称 ;
②在连接c和d时,使d较易插入c中的措施是 ;
(2)采用图2所示操作可能造成的后果之一是 ;
(3)利用图3装置(夹持装置未画出)能进行的实验是 (选填序号);
A.用高锰酸钾制氧气; B.用石灰石与稀盐酸制二氧化碳;C.用锌与稀硫酸制氢气; D.用双氧水与二氧化锰制氧气.
(4)图3中的气体发生装置虽然简单,操作方便,但无法控制反应速率.请从图4中选取 (选填序号)与图1中a组装成新的气体发生装置,以达到控制反应速率的目的.
(5)实验室用图5中A装置制氧气的化学方程式是____________反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是________黑色粉末在反应中的作用是_________.用E装置收集氧气的依据是________,检验氧气是否集满的方法是___________ .
(6)机动车排放的尾气是空气的重要污染源,其成分之一是NO.某化学兴趣小组的同学在查阅资料后得知:
①NO常温下是一种无色、难溶于水的气体,它的密度比空气略大;
②NO常温下能与氧气迅速反应,生成红棕色的NO2气体:2NO2+O2=2NO2;
③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4X.
根据以上信息完成下列问题:①物质X的化学式为 . ②若选择合适的装置来制取并收集NO气体,你选择图5中的发生装置是 ,收集装置是 .
③该小组的同学通过查阅资料你得到的启示是__________
a.NO容易和血红蛋白结合而使人中毒;b.NO能抗击侵入人体的微生物,并能阻止癌细 胞的繁殖和肿瘤细胞的扩散.综合分析①和②的信息,
④某化工厂准备生产Cu)NO3)2,以铜和稀硝酸为主要原料设计了两种方案:
方案一:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4X;
方案二:2Cu+O2 2CuO,CuO+2HNO3=Cu(NO3)2+H2O.
2CuO,CuO+2HNO3=Cu(NO3)2+H2O.
从环境保护的角度考虑,你认为较合理的方案是 .从经济角度考虑选择此方案的理由是 .
(7)某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、II、III),充分反应后,将得到的实验数据绘制出如图象图6:试回答(计算结果精确到0.1%):
①写出实验中有关的化学方程式:_____________.
②实验I中铁参加反应的质量为_________.
③稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是____.
查看习题详情和答案>>
②在连接c和d时,使d较易插入c中的措施是 ;
(2)采用图2所示操作可能造成的后果之一是 ;
(3)利用图3装置(夹持装置未画出)能进行的实验是 (选填序号);
A.用高锰酸钾制氧气; B.用石灰石与稀盐酸制二氧化碳;C.用锌与稀硫酸制氢气; D.用双氧水与二氧化锰制氧气.
(4)图3中的气体发生装置虽然简单,操作方便,但无法控制反应速率.请从图4中选取 (选填序号)与图1中a组装成新的气体发生装置,以达到控制反应速率的目的.
(5)实验室用图5中A装置制氧气的化学方程式是____________反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是________黑色粉末在反应中的作用是_________.用E装置收集氧气的依据是________,检验氧气是否集满的方法是___________ .
(6)机动车排放的尾气是空气的重要污染源,其成分之一是NO.某化学兴趣小组的同学在查阅资料后得知:
①NO常温下是一种无色、难溶于水的气体,它的密度比空气略大;
②NO常温下能与氧气迅速反应,生成红棕色的NO2气体:2NO2+O2=2NO2;
③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4X.
根据以上信息完成下列问题:①物质X的化学式为 . ②若选择合适的装置来制取并收集NO气体,你选择图5中的发生装置是 ,收集装置是 .
③该小组的同学通过查阅资料你得到的启示是__________
a.NO容易和血红蛋白结合而使人中毒;b.NO能抗击侵入人体的微生物,并能阻止癌细 胞的繁殖和肿瘤细胞的扩散.综合分析①和②的信息,
④某化工厂准备生产Cu)NO3)2,以铜和稀硝酸为主要原料设计了两种方案:
方案一:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4X;
方案二:2Cu+O2
 2CuO,CuO+2HNO3=Cu(NO3)2+H2O.
2CuO,CuO+2HNO3=Cu(NO3)2+H2O.从环境保护的角度考虑,你认为较合理的方案是 .从经济角度考虑选择此方案的理由是 .
(7)某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、II、III),充分反应后,将得到的实验数据绘制出如图象图6:试回答(计算结果精确到0.1%):
①写出实验中有关的化学方程式:_____________.
②实验I中铁参加反应的质量为_________.
③稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是____.
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学收集某地的雨水进行实验.
【相关信息】①每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
②SO2能使品红溶液褪色;
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO3不溶于水,能与盐酸反应;BaSO4不溶于水,也不溶于盐酸.
【分析讨论】①正常雨水的pH范围是:7>pH>5.6,偏酸性,这是因为 .
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于 .
③收集的酸雨样品放置一段时间后pH减小,原因是SO2与水反应生成的H2SO3被氧化为H2SO4.试写出该反应的化学方程式 .
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:酸雨中溶质只含有H2SO3;
猜想Ⅱ:酸雨中溶质只含有H2SO4;
猜想Ⅲ:酸雨中溶质 .
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)2溶液,有白色沉淀生成,过滤.
①在滤液中滴加 溶液,溶液呈 色.证明在酸雨样品中滴加的Ba(OH)2溶液已过量.
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体.该反应的化学方程式为 ,根此现象有关酸雨中溶质的猜想 正确.
(2)某同学取酸雨样品V L,加入17.1%的Ba(OH)2溶液至不再产生沉淀时,恰好消耗10.00g Ba(OH)2溶液.该V L酸雨样品中溶解SO2的质量为 .
实验反思:在某些酸雨中还可分析出有硝酸存在,这是由于空气中含有某元素+4价氧化物的原因,这种氧化物的化学式为 .
拓展延伸:利用海水脱硫是减少SO2排放的有效方法,其工艺流程如下图所示:
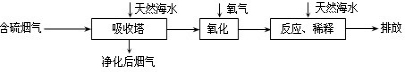
天然海水吸收了较多的含硫烟气后,有H2SO3生成,H2SO3与海水中的离子反应,会释放出CO2,通入氧气后氧化后,海水的酸性显著增强.
①设计一种检验净化后的烟气中是否含SO2的简单的实验方案: .
②氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 .
查看习题详情和答案>>
【相关信息】①每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO3不溶于水,能与盐酸反应;BaSO4不溶于水,也不溶于盐酸.
【分析讨论】①正常雨水的pH范围是:7>pH>5.6,偏酸性,这是因为
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于
③收集的酸雨样品放置一段时间后pH减小,原因是SO2与水反应生成的H2SO3被氧化为H2SO4.试写出该反应的化学方程式
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:酸雨中溶质只含有H2SO3;
猜想Ⅱ:酸雨中溶质只含有H2SO4;
猜想Ⅲ:酸雨中溶质
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)2溶液,有白色沉淀生成,过滤.
①在滤液中滴加
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体.该反应的化学方程式为
(2)某同学取酸雨样品V L,加入17.1%的Ba(OH)2溶液至不再产生沉淀时,恰好消耗10.00g Ba(OH)2溶液.该V L酸雨样品中溶解SO2的质量为
实验反思:在某些酸雨中还可分析出有硝酸存在,这是由于空气中含有某元素+4价氧化物的原因,这种氧化物的化学式为
拓展延伸:利用海水脱硫是减少SO2排放的有效方法,其工艺流程如下图所示:

天然海水吸收了较多的含硫烟气后,有H2SO3生成,H2SO3与海水中的离子反应,会释放出CO2,通入氧气后氧化后,海水的酸性显著增强.
①设计一种检验净化后的烟气中是否含SO2的简单的实验方案:
②氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学收集某地的雨水进行实验.
【相关信息】①每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO3不溶于水,能与盐酸反应;BaSO4不溶于水,也不溶于盐酸.
【分析讨论】①正常雨水的pH范围是:7>pH>5.6,偏酸性,这是因为________.
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于________.
③收集的酸雨样品放置一段时间后pH减小,原因是SO2与水反应生成的H2SO3被氧化为H2SO4.试写出该反应的化学方程式________.
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:酸雨中溶质只含有H2SO3;
猜想Ⅱ:酸雨中溶质只含有H2SO4;
猜想Ⅲ:酸雨中溶质________.
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)2溶液,有白色沉淀生成,过滤.
①在滤液中滴加________溶液,溶液呈________色.证明在酸雨样品中滴加的Ba(OH)2溶液已过量.
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体.该反应的化学方程式为________,根此现象有关酸雨中溶质的猜想________正确.
(2)某同学取酸雨样品V L,加入17.1%的Ba(OH)2溶液至不再产生沉淀时,恰好消耗10.00g Ba(OH)2溶液.该V L酸雨样品中溶解SO2的质量为________.
实验反思:在某些酸雨中还可分析出有硝酸存在,这是由于空气中含有某元素+4价氧化物的原因,这种氧化物的化学式为________.
拓展延伸:利用海水脱硫是减少SO2排放的有效方法,其工艺流程如下图所示:
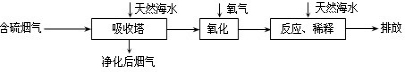
天然海水吸收了较多的含硫烟气后,有H2SO3生成,H2SO3与海水中的离子反应,会释放出CO2,通入氧气后氧化后,海水的酸性显著增强.
①设计一种检验净化后的烟气中是否含SO2的简单的实验方案:________.
②氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是________. 查看习题详情和答案>>