��Ŀ����
��ѧ��һ����ʵ��Ϊ�����Ŀ�ѧ��


ͼ6
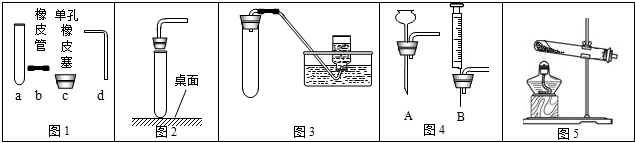
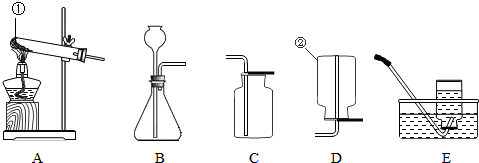
��1������ͼ1�ش𣺢�д��a������ ��
��������c��dʱ��ʹd���ײ���c�еĴ�ʩ�� ��
��2������ͼ2��ʾ����������ɵĺ��֮һ�� ��
��3������ͼ3װ�ã��г�װ��δ�������ܽ��е�ʵ���� ��ѡ����ţ���
A���ø�������������� B����ʯ��ʯ��ϡ�����ƶ�����̼��C����п��ϡ������������ D����˫��ˮ�����������������
��4��ͼ3�е����巢��װ����Ȼ���������㣬�������Ʒ�Ӧ���ʣ����ͼ4��ѡȡ ��ѡ����ţ���ͼ1��a��װ���µ����巢��װ�ã��Դﵽ���Ʒ�Ӧ���ʵ�Ŀ�ģ�
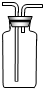
��5��ʵ������ͼ5��Aװ���������Ļ�ѧ����ʽ��____________��Ӧ��������ȴ�����Թ��м���������ˮ�����衢���ˣ��õ���ɫ��ĩ���ú�ɫ��ĩ���������Ӵ��д������ݲ�������Ӧ�Ļ�ѧ����ʽ��________��ɫ��ĩ�ڷ�Ӧ�е�������_________����Eװ���ռ�������������________�����������Ƿ����ķ�����___________ ��
��6���������ŷŵ�β���ǿ�������Ҫ��ȾԴ����ɷ�֮һ��NO��ij��ѧ��ȤС���ͬѧ�ڲ������Ϻ��֪��
��NO��������һ����ɫ��������ˮ�����壬�����ܶȱȿ����Դ�
��NO��������������Ѹ�ٷ�Ӧ�����ɺ���ɫ��NO2���壺2NO2+O2=2NO2��
��ʵ���ҳ���ͭ��ϡ���ᷴӦ��ȡNO��3Cu+8HNO3��ϡ��=3Cu(NO3)2+2NO��+4X��
����������Ϣ����������⣺������X�Ļ�ѧʽΪ �� ����ѡ����ʵ�װ������ȡ���ռ�NO���壬��ѡ��ͼ5�еķ���װ���� ���ռ�װ���� ��
�۸�С���ͬѧͨ������������õ�����ʾ��__________
a��NO����Ѫ�쵰��϶�ʹ���ж���b��NO�ܿ���������������������ֹ��ϸ ���ķ�ֳ������ϸ������ɢ���ۺϷ����ٺ͢ڵ���Ϣ��
��ij������������Cu)NO3)2����ͭ��ϡ����Ϊ��Ҫԭ����������ַ�����
����һ��3Cu+8HNO3��ϡ��=3Cu(NO3)2+2NO��ʮ4X��
��������2Cu+O2 2CuO��CuO+2HNO3=Cu(NO3)2+H2O��
2CuO��CuO+2HNO3=Cu(NO3)2+H2O��
�ӻ��������ĽǶȿ��ǣ�����Ϊ�Ϻ����ķ����� ���Ӿ��ýǶȿ���ѡ��˷����������� ��
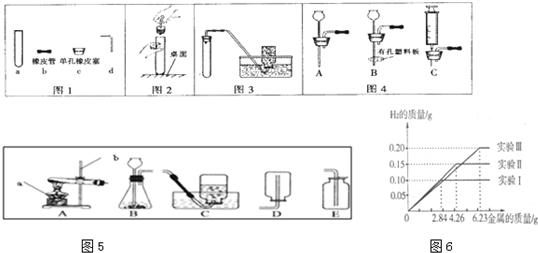
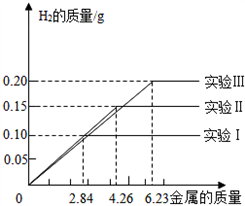
��7��ij��ѧ����С���ͬѧ���������������飮���dz�ȡ�����ȫ��ͬ������Ϊ2.84g��4.26g��6.23g�����ݸ��������������ֻ������̼�����ֱ����100gϡ�����н���ʵ�飨ʵ��I��II��III������ַ�Ӧ���õ���ʵ�����ݻ��Ƴ���ͼ��ͼ6���Իش𣨼�������ȷ��0.1%����
��д��ʵ�����йصĻ�ѧ����ʽ��_____________��
��ʵ��I�����μӷ�Ӧ������Ϊ_________��
��ϡ������ȫ�μӷ�Ӧ��ʵ���У���Ӧ����Һ�����ʵ�����������____��
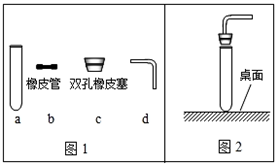
��������c��dʱ��ʹd���ײ���c�еĴ�ʩ�� ��
��2������ͼ2��ʾ����������ɵĺ��֮һ�� ��
��3������ͼ3װ�ã��г�װ��δ�������ܽ��е�ʵ���� ��ѡ����ţ���
A���ø�������������� B����ʯ��ʯ��ϡ�����ƶ�����̼��C����п��ϡ������������ D����˫��ˮ�����������������
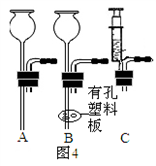
��4��ͼ3�е����巢��װ����Ȼ���������㣬�������Ʒ�Ӧ���ʣ����ͼ4��ѡȡ ��ѡ����ţ���ͼ1��a��װ���µ����巢��װ�ã��Դﵽ���Ʒ�Ӧ���ʵ�Ŀ�ģ�
��5��ʵ������ͼ5��Aװ���������Ļ�ѧ����ʽ��____________��Ӧ��������ȴ�����Թ��м���������ˮ�����衢���ˣ��õ���ɫ��ĩ���ú�ɫ��ĩ���������Ӵ��д������ݲ�������Ӧ�Ļ�ѧ����ʽ��________��ɫ��ĩ�ڷ�Ӧ�е�������_________����Eװ���ռ�������������________�����������Ƿ����ķ�����___________ ��
��6���������ŷŵ�β���ǿ�������Ҫ��ȾԴ����ɷ�֮һ��NO��ij��ѧ��ȤС���ͬѧ�ڲ������Ϻ��֪��
��NO��������һ����ɫ��������ˮ�����壬�����ܶȱȿ����Դ�
��NO��������������Ѹ�ٷ�Ӧ�����ɺ���ɫ��NO2���壺2NO2+O2=2NO2��
��ʵ���ҳ���ͭ��ϡ���ᷴӦ��ȡNO��3Cu+8HNO3��ϡ��=3Cu(NO3)2+2NO��+4X��
����������Ϣ����������⣺������X�Ļ�ѧʽΪ �� ����ѡ����ʵ�װ������ȡ���ռ�NO���壬��ѡ��ͼ5�еķ���װ���� ���ռ�װ���� ��
�۸�С���ͬѧͨ������������õ�����ʾ��__________
a��NO����Ѫ�쵰��϶�ʹ���ж���b��NO�ܿ���������������������ֹ��ϸ ���ķ�ֳ������ϸ������ɢ���ۺϷ����ٺ͢ڵ���Ϣ��
��ij������������Cu)NO3)2����ͭ��ϡ����Ϊ��Ҫԭ����������ַ�����
����һ��3Cu+8HNO3��ϡ��=3Cu(NO3)2+2NO��ʮ4X��
��������2Cu+O2
 2CuO��CuO+2HNO3=Cu(NO3)2+H2O��
2CuO��CuO+2HNO3=Cu(NO3)2+H2O���ӻ��������ĽǶȿ��ǣ�����Ϊ�Ϻ����ķ����� ���Ӿ��ýǶȿ���ѡ��˷����������� ��
��7��ij��ѧ����С���ͬѧ���������������飮���dz�ȡ�����ȫ��ͬ������Ϊ2.84g��4.26g��6.23g�����ݸ��������������ֻ������̼�����ֱ����100gϡ�����н���ʵ�飨ʵ��I��II��III������ַ�Ӧ���õ���ʵ�����ݻ��Ƴ���ͼ��ͼ6���Իش𣨼�������ȷ��0.1%����
��д��ʵ�����йصĻ�ѧ����ʽ��_____________��
��ʵ��I�����μӷ�Ӧ������Ϊ_________��
��ϡ������ȫ�μӷ�Ӧ��ʵ���У���Ӧ����Һ�����ʵ�����������____��
��1���Թܣ���ˮʪ��
��2���Թ����ѣ�
��3��CD��
��4��B��C��
��5��2KClO3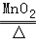 2KCl+3O2����2H2O2
2KCl+3O2����2H2O2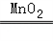 2H2O+O2���������������ܶȴ��ڿ������ܶȣ��������ǵ�ľ�����ڼ���ƿ�ڣ�ľ����ȼ˵��������
2H2O+O2���������������ܶȴ��ڿ������ܶȣ��������ǵ�ľ�����ڼ���ƿ�ڣ�ľ����ȼ˵��������
��6����H2O��B��C�����κ����ʶ����������ԣ��ܷ�������������ͬ����������ͭ�����ĵ�ϡ�����٣�
��7����Fe+H2SO4=FeSO4+H2������2.8g
���ɱ������ݷ�����ʵ��III��100gϡ������ȫ��Ӧ��
��ʵ��III������������������Ϊx��������������Ϊy��
Fe+H2SO4=FeSO4+H2��
56 152 2
y x 0.2g
 =
=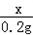 ��
��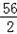 =
=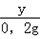
x=15.2g y=5.6g
������Һ�����ʵ���������Ϊ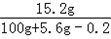 ��100%=14.4%��
��100%=14.4%��
�𣺷�Ӧ����Һ�����ʵ�����������14.4%��
��2���Թ����ѣ�
��3��CD��
��4��B��C��
��5��2KClO3
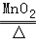 2KCl+3O2����2H2O2
2KCl+3O2����2H2O2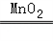 2H2O+O2���������������ܶȴ��ڿ������ܶȣ��������ǵ�ľ�����ڼ���ƿ�ڣ�ľ����ȼ˵��������
2H2O+O2���������������ܶȴ��ڿ������ܶȣ��������ǵ�ľ�����ڼ���ƿ�ڣ�ľ����ȼ˵����������6����H2O��B��C�����κ����ʶ����������ԣ��ܷ�������������ͬ����������ͭ�����ĵ�ϡ�����٣�
��7����Fe+H2SO4=FeSO4+H2������2.8g
���ɱ������ݷ�����ʵ��III��100gϡ������ȫ��Ӧ��
��ʵ��III������������������Ϊx��������������Ϊy��
Fe+H2SO4=FeSO4+H2��
56 152 2
y x 0.2g
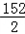 =
=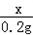 ��
��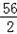 =
=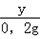
x=15.2g y=5.6g
������Һ�����ʵ���������Ϊ
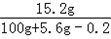 ��100%=14.4%��
��100%=14.4%�� �𣺷�Ӧ����Һ�����ʵ�����������14.4%��

��ϰ��ϵ�д�
�����Ŀ
 20����ѧ��һ����ʵ��Ϊ�����Ŀ�ѧ���淶��ʵ�������ʵ��ɹ���ǰ�ᣬ��ش�
20����ѧ��һ����ʵ��Ϊ�����Ŀ�ѧ���淶��ʵ�������ʵ��ɹ���ǰ�ᣬ��ش�