网址:http://m.1010jiajiao.com/timu3_id_93968[举报]
| ||
| ||
[提出问题]单质碳也具有还原性,碳还原氧化铁的化学方程式为
| ||
| ||
[猜想与假设]焦炭和铁矿石都是固体,接触面积小,反应不易完全.
[进行实验]实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末.一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中.
②装置A和B两组实验同时开始进行.在装置B的反应中,实验开始前应先
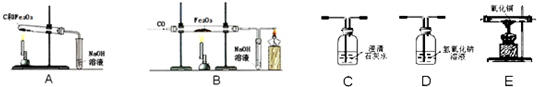
[实验现象]当装置B的玻璃管中固体完全由
[解释与结论]焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因.
[交流与反思]经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个:
[完善实验]联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生.为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过下图的检验装置,正确的连接顺序是
⑴请写出高炉炼铁的主要原理是(用化学方程式表示)______________。
⑵通过学习炼铁的过程,我终于知道“钢铁是怎样炼成的”。你认为我说的科学吗?谈谈你的看法:____________________________。
 (2012?通州区二模)人类生活离不开金属.
(2012?通州区二模)人类生活离不开金属.(1)下列物质中,主要利用金属材料制成的是(填序号)
①钙片 ②不锈钢锅 ③玻璃车窗 ④塑料保鲜膜
(2)铁是生活中常用的金属.如图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热原理是利用铁生锈时放热.
①发热剂需接触到空气才会发热,原因是铁要与
②上述的铁粉是通过炼铁厂以焦炭、赤铁矿(主要成分是氧化铁Fe2O3)、空气等为主要原料冶炼出来的,请写出其中一氧化碳与氧化铁反应的化学方程式:
| ||
| ||
(3)常见的食品脱氧剂多为无机体系脱氧剂,其主要成分为活性铁粉.某同学自制脱氧剂(2g铁粉、0.5g食盐)进行如下两个实验:
【实验Ⅰ】
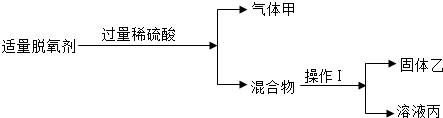
请回答:操作1的名称是
【实验Ⅱ】
取溶液丙加入一些锌粉,充分反应后过滤,下列滤液和滤渣的说法中正确的是
A、滤渣中一定含有Fe、Zn B、滤渣中一定含有Fe C、滤液中一定含有NaCl、ZnSO4,可能含有FeSO4、H2SO4
.
人类的生产生活离不开金属材料.
(1)铝、铁、铜是使用比较广泛的金属.
①如图1所示用品中,利用金属导热性的是__________,延展性的是___________ (填字母序号).
②铝具有很好的抗腐蚀性能,原因是__________________________(用化学方程式表示).

(2)焊锡(锡铅合金)常用于焊接电子元件.下表是一些金属的熔点数据.
| 金属 | 锡 | 铅 | 铋 |
|
| 熔点/℃ | 231.9 | 327.5 | 271.3 | 320.9 |
①锡铅合金中某种金属的质量分数与合金的熔点有如图2所示的关系,
其中横坐标表示的是_________的质量分数(填字母序号).
A.锡 B.铅 C.无法确定
②保险丝由铋、铅、锡、镉组成,其熔点约为________ (填字母序号).
A.15~30℃ B.60~80℃ C.231~328℃
(3)金属钛(Ti)的合金广泛用于航空、航天及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4.其反应的化学方程式为:2FeTiO3 + 6C + 7Cl2  2TiCl4 + 2X + 6CO.然后用镁与TiCl4,在高温条件下反应生成金属钛和氯化镁.
2TiCl4 + 2X + 6CO.然后用镁与TiCl4,在高温条件下反应生成金属钛和氯化镁.
请根据以上信息回答下列问题:
①FeTiO3中钛元素的化合价为 . ②在制备TiCl4的反应中,X的化学式为 .
③镁与TiCl4反应的化学方程式为 .
(4)黄铜外观似黄金但质地坚硬.将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种锌和铜的合金即黄铜.发生的化学反应有:
 |
ZnCO3 === ZnO + CO2↑, 2Cu2O + C === 4Cu+CO2↑, 2ZnO + C === 2Zn+CO2↑
若原料中含72吨赤铜,充分反应后,理论上所得黄铜中铜的质量为多少?(写出计算过程)
查看习题详情和答案>>(1)铝、铁、铜是使用比较广泛的金属.
①如图1所示用品中,利用金属导热性的是
②铝具有很好的抗腐蚀性能,原因是
(2)焊锡(锡铅合金)常用于焊接电子元件.下表是一些金属的熔点数据.
| 金属 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 231.9 | 327.5 | 271.3 | 320.9 |
其中横坐标表示的是
A.锡 B.铅 C.无法确定

②保险丝由铋、铅、锡、镉组成,其熔点约为
A.15~30℃B.60~80℃C.231~328℃
(3)金属钛(Ti)的合金广泛用于航空、航天及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4.其反应的化学方程式为:2FeTiO3+6C+7Cl2
| ||
请根据以上信息回答下列问题:
①FeTiO3中钛元素的化合价为
③镁与TiCl4反应的化学方程式为
(4)黄铜外观似黄金但质地坚硬.将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种锌和铜的合金即黄铜.发生的化学反应有:
ZnCO3
| ||
| ||
| ||
若原料中含72吨赤铜,充分反应后,理论上所得黄铜中铜的质量为多少?(写出计算过程)
 镉
镉