摘要:52.某同学配置一定溶质质量分数的氯化钠溶液.实验完毕后.实际配置的溶液的溶质质量分数比实验要求的低.试问造成这一结果的原因可能是: 参考答案:①量筒读数时仰视,②称量时左码右物,③游码读数时读了游码右侧的数 ④药品氯化钠含水,⑤氯化钠有部分残留在天平托盘上的滤纸中 等等
网址:http://m.1010jiajiao.com/timu3_id_92023[举报]
某同学用提取的精盐利用如图所示进行“配制质量分数一定的氯化钠溶液”的实验:

(1)图C中仪器的名称是
(2)完成此实验正确的操作顺序是:
(3)按实验要求,图A中还缺少的玻璃仪器是
(4)小婧按图B的操作称取氯化钠,小民发现小婧的操作有错误.你认为小婧操作中的错误是
(5)反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会
查看习题详情和答案>>

(1)图C中仪器的名称是
量筒
量筒
;(2)完成此实验正确的操作顺序是:
③④①②
③④①②
(填序号);①溶解②把配制好的溶液装入试剂瓶③计算④称量(3)按实验要求,图A中还缺少的玻璃仪器是
玻璃棒
玻璃棒
(填名称)作用是加速固体溶解
加速固体溶解
.(4)小婧按图B的操作称取氯化钠,小民发现小婧的操作有错误.你认为小婧操作中的错误是
物码倒置或砝码放于左盘,氯化钠放于右盘
物码倒置或砝码放于左盘,氯化钠放于右盘
;(5)反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会
偏小
偏小
(填“偏大”、“偏小”或“无影响”).某化学研究性学习小组欲测定实验室里一瓶久置的NaOH固体是否变质.请你和该小组的同学一起完成如下实验探究:
【作出猜想】猜想I:没变质,全部是NaOH;
猜想II:
猜想Ⅲ:完全变质,全部是Na2CO3.
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题.
上述步骤①中,滴加过量BaCl2溶液的目的是
【实验结论】通过实验,说明上述猜想中
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为3.94g,求原试剂中NaOH的质量分数.(写出计算过程,假定试剂中无其它杂质).
查看习题详情和答案>>
【作出猜想】猜想I:没变质,全部是NaOH;
猜想II:
部分变质,既含有NaOH,又含有Na2CO3
部分变质,既含有NaOH,又含有Na2CO3
猜想Ⅲ:完全变质,全部是Na2CO3.
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
| 盐溶液 | NaCI | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.0g溶于50ml水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置. | 产生白色沉淀 产生白色沉淀 |
说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH | pH=11 |
说明久置固体中,还一定含有 NaOH NaOH |
使样品中的Na2C03完全反应
使样品中的Na2C03完全反应
.【实验结论】通过实验,说明上述猜想中
Ⅱ
Ⅱ
是正确的.【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为3.94g,求原试剂中NaOH的质量分数.(写出计算过程,假定试剂中无其它杂质).
某化学研究性学习小组欲测定实验室里一瓶久置的NaOH固体是否变质。
【作出猜想】猜想I:没变质,全部是NaOH;猜想II:_▲_;猜想Ⅲ:完全变质,全部是Na2CO3。
【查阅资料】①已知反应: BaCl2+Na2CO3=2NaCl+BaCO3↓
BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
| 盐溶液 | NaCI | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于 | 等于7 |
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题。
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.0g溶于50ml水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置。 | ▲ | 说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH | pH=11 | 说明久置固体中,还一定含有 ▲ |
上述步骤① 中,滴加过量BaCl2溶液的目的是 ▲ 。
中,滴加过量BaCl2溶液的目的是 ▲ 。
【实验结论】通过实验,说明上述猜想中 ▲ 是正确的。
是正确的。
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为3.94g,求原试剂中NaOH的质 量分数。(写出计算过程,假定试剂中无其它杂质)。
量分数。(写出计算过程,假定试剂中无其它杂质)。
化学中质量守恒定律是一个非常重要的定量定律.
(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1________m2,其原因为________.
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如图所示.
①1个B分子中含有________个原子.
②四种物质中属于化合物的是________(填图中字母).
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是l0g.有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
【设计方案】
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00g.乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳.
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1% )________. 查看习题详情和答案>>
化学中质量守恒定律是一个非常重要的定量定律.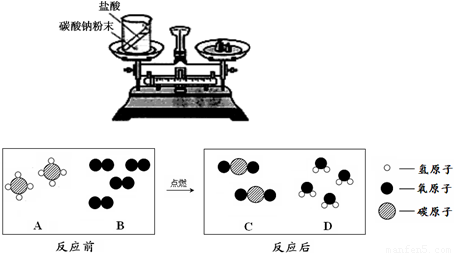
(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1______m2,其原因为______.
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如图所示.
①1个B分子中含有______个原子.
②四种物质中属于化合物的是______(填图中字母).
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是l0g.有关实验数据见下表:
X:Y的比值可能为______或______.
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
【设计方案】
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00g.乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳.
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1% )______.
查看习题详情和答案>>

(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1______m2,其原因为______.
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如图所示.
①1个B分子中含有______个原子.
②四种物质中属于化合物的是______(填图中字母).
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是l0g.有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
【设计方案】
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00g.乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳.
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1% )______.
查看习题详情和答案>>