摘要:20.m g的H2O2与1gMnO2混合.完全反应后剩余的残留物的质量为n g.则生成氧气的质量为 A.g B.(m-n)g C.(n-1)g D.g 第Ⅱ卷
网址:http://m.1010jiajiao.com/timu3_id_90866[举报]
已知钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑.质量均为m g的钠、镁、锌三种金属分别与25g 质量分数为19.6% 的稀硫酸反应.
(1)由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量的情况表示为Na>Mg=Zn.请按以上表示,写出所有可能情况.
(2)试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围
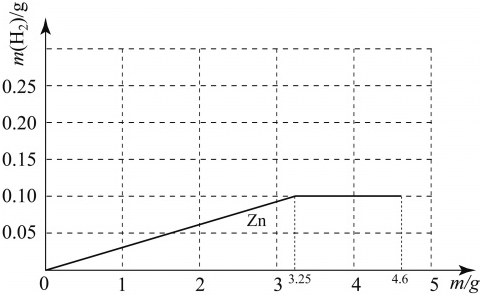
(3)m=4.6 时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图.请在图中再画出钠和镁二种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线.(在图线上用元素符号注明)
查看习题详情和答案>>
(1)由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量的情况表示为Na>Mg=Zn.请按以上表示,写出所有可能情况.
Na>Mg>Zn Na=Mg>Zn、Mg>Na>Zn
Na>Mg>Zn Na=Mg>Zn、Mg>Na>Zn
(2)试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围
m≥3.25
m≥3.25
.(3)m=4.6 时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图.请在图中再画出钠和镁二种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线.(在图线上用元素符号注明)

29、为制取并收集一瓶干燥的CO2气体,某课外研究小组向实验教师领取了下列仪器和药品:
(1)写出编号仪器的名称①
(2)实验室制取CO2时发生反应的化学方程式为
(3)收集CO2时,他们如何检验CO2已收集满?
(4)本实验的装置也可以用来制取我们所熟悉的一种气体是
(5)实验室制取气体要选择适当反应物.我们知道实验室制取大量CO2气体不能用浓盐酸和大理石为原料,因为
①取m g大理石粉末与足量的溶质质量分数为5%的盐酸反应;
②取m g块状大理石与足量的溶质质量分数为5%的盐酸反应;
③取m g大理石粉末与足量的溶质质量分数为10%的盐酸反应;
④取m g块状大理石与足量的溶质质量分数为10%的盐酸反应.
实验现象:产生气泡的快慢顺序为③>①>④>②.
实验结论:影响大理石和盐酸反应产生CO2快慢的因素有
查看习题详情和答案>>

(1)写出编号仪器的名称①
锥形瓶
;⑥集气瓶
.要完成该实验,他们还必须向实验老师领取的仪器有镊子、火柴和
洗气瓶
.(2)实验室制取CO2时发生反应的化学方程式为
2HCl+CaCO3=CaCl2+H2O+CO2↑
.(3)收集CO2时,他们如何检验CO2已收集满?
把燃着的火柴平放到集气瓶口,火柴若熄灭,证明已收集满二氧化碳
;(4)本实验的装置也可以用来制取我们所熟悉的一种气体是
氧气
;(5)实验室制取气体要选择适当反应物.我们知道实验室制取大量CO2气体不能用浓盐酸和大理石为原料,因为
浓盐酸易挥发,会使收集的CO2不纯
;也不能用稀硫酸和大理石为原料,因为
稀硫酸和大理石反应生成CaSO4不溶于水,会阻碍反应的继续进行
.他们对实验室制取CO2的实验条件展开了进一步的探究,做了如下四个对比实验:①取m g大理石粉末与足量的溶质质量分数为5%的盐酸反应;
②取m g块状大理石与足量的溶质质量分数为5%的盐酸反应;
③取m g大理石粉末与足量的溶质质量分数为10%的盐酸反应;
④取m g块状大理石与足量的溶质质量分数为10%的盐酸反应.
实验现象:产生气泡的快慢顺序为③>①>④>②.
实验结论:影响大理石和盐酸反应产生CO2快慢的因素有
大理石与盐酸的接触面积和盐酸的溶质质量分数.
.如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器.试根据题目要求,回答下列问题:

(1)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳气体.(提示:盐酸中会发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为
②生成二氧化碳时,所发生反应的化学方程式为
(2)收集CO2时,他们如何检验已CO2收集满?
(3)实验室制取气体要选择适当反应物.我们知道实验室制取大量CO2气体不能用浓盐酸,因为
(4)他们对实验室制取CO2的实验条件展开了进一步的探究,做了如下四个对比实验:
①取m g块状大理石与足量的溶质质量分数为5%的盐酸反应;
②取m g块状大理石与足量的溶质质量分数为10%的盐酸反应.
实验现象:产生气泡的快慢顺序为②>①.
实验结论:影响大理石和盐酸反应快慢的因素有
查看习题详情和答案>>

(1)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳气体.(提示:盐酸中会发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为
ACBF
ACBF
(填写仪器序号字母).②生成二氧化碳时,所发生反应的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.(2)收集CO2时,他们如何检验已CO2收集满?
将燃着的木条伸到集齐平口,木条熄灭
将燃着的木条伸到集齐平口,木条熄灭
;(3)实验室制取气体要选择适当反应物.我们知道实验室制取大量CO2气体不能用浓盐酸,因为
挥发出氯化氢气体,收集到二氧化碳不纯
挥发出氯化氢气体,收集到二氧化碳不纯
.(4)他们对实验室制取CO2的实验条件展开了进一步的探究,做了如下四个对比实验:
①取m g块状大理石与足量的溶质质量分数为5%的盐酸反应;
②取m g块状大理石与足量的溶质质量分数为10%的盐酸反应.
实验现象:产生气泡的快慢顺序为②>①.
实验结论:影响大理石和盐酸反应快慢的因素有
稀盐酸的质量分数
稀盐酸的质量分数
.你认为影响大理石和盐酸反应快慢的因素还有大理石颗粒大小
大理石颗粒大小
.27、某校化学兴趣小组的同学对敞口放置的固体烧碱的变质程度开展了探究.
写出烧碱发生变质反应的化学方程式:
为确定固体混合物中碳酸钠的质量分数,他们设计了如下几种不同的实验方案:
[方案一]气体分析法.
(1)如图1所示(铁夹夹持的仪器是理想无摩擦注射器),把X g的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.检查该装置的气密性的方法是

(2)有同学提出以图2代替图1中的收集装置,则所测CO2气体的体积
(3)也有人用图3装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物).则图3实验装置主要存在哪些缺陷?这些缺陷对实验结果有何影响?(选1点填入下表)
过量BaCl2溶液操作1称取X g固体混合物溶解洗涤烘干称量溶液M沉淀AYg沉淀
[方案二]沉淀分析法.

(1)“操作1”的名称是
(2)确定BaCl2溶液是否过量的方法是
(3)导致测定的结果偏大的原因可能是
查看习题详情和答案>>
写出烧碱发生变质反应的化学方程式:
2NaOH+CO2═Na2CO3+H2O
为确定固体混合物中碳酸钠的质量分数,他们设计了如下几种不同的实验方案:
[方案一]气体分析法.
(1)如图1所示(铁夹夹持的仪器是理想无摩擦注射器),把X g的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.检查该装置的气密性的方法是
将注射器活塞拉出一定距离,一段时间后松开活塞,活塞能回到原位则不漏气
.
(2)有同学提出以图2代替图1中的收集装置,则所测CO2气体的体积
偏小
(填“偏大”、“偏小”、“不变”),理由是CO2能溶于水且与水反应
,你的改进方案是在水面上覆盖一层植物油
;广口瓶内原有的空气对实验结果没有
(填“有”或“没有”)影响.(3)也有人用图3装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物).则图3实验装置主要存在哪些缺陷?这些缺陷对实验结果有何影响?(选1点填入下表)
| 主要缺陷 | 对实验结果的影响 |
[方案二]沉淀分析法.

(1)“操作1”的名称是
过滤
.(2)确定BaCl2溶液是否过量的方法是
静置,向上层清液中继续滴加BaCl2溶液,若无沉淀说明BaCl2溶液已过量
.(3)导致测定的结果偏大的原因可能是
沉淀未洗涤干净
.