题目内容
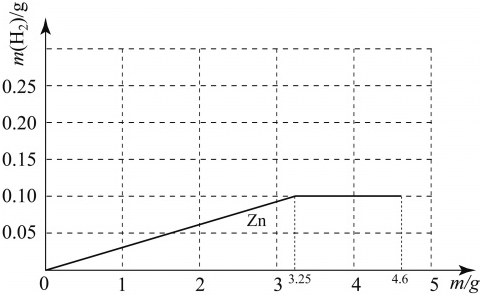
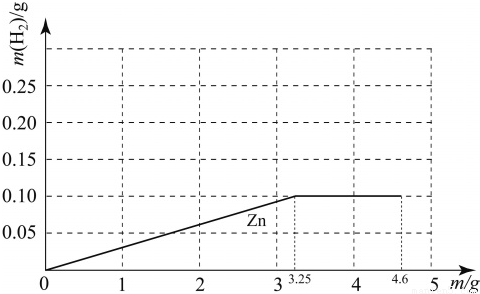
已知钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑.质量均为m g的钠、镁、锌三种金属分别与25g 质量分数为19.6% 的稀硫酸反应.由于金属的质量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都大于钠产生的氢气质量的情况表示为Mg=Zn>Na.若m=3g时,下列表示正确的是( )
分析:利用三种金属与定量的酸反应所需的金属量分析酸液是否有剩余,而后结合有关的题目信息和相关的化学方程式的计算分析解答即可;
解答:解:设:①25g质量分数为19.6% 的稀硫酸与锌恰好完全反应消耗锌的质量为x
Zn+H2SO4 ═ZnSO4+H2↑
65 98
x 25g×19.6%
=
解得:x=3.25g>3g,所以锌完全反应酸有剩余;
②设25g质量分数为19.6% 的稀硫酸与镁恰好完全反应消耗镁的质量为y
Mg+H2SO4 ═MgSO4+H2↑
24 98
y 25g×19.6%
=
y=1.2g<3g,故酸完全反应;
③设25g质量分数为19.6% 的稀硫酸与钠恰好完全反应消耗钠的质量为z
2Na+H2SO4 =Na2SO4 +H2↑
46 98
z 25g×19.6%
=
z=2.3g<3g,所以硫酸能够完全反应,由于剩余的钠还能够和水反应生成氢气,故生成氢气质量关系为:钠>镁>锌(镁锌的氢气来源于酸中的氢,而钠生成的氢气含有酸中的氢和反应的水中的部分分氢);
故选C
Zn+H2SO4 ═ZnSO4+H2↑
65 98
x 25g×19.6%
| 65 |
| x |
| 98 |
| 25g×19.6% |
解得:x=3.25g>3g,所以锌完全反应酸有剩余;
②设25g质量分数为19.6% 的稀硫酸与镁恰好完全反应消耗镁的质量为y
Mg+H2SO4 ═MgSO4+H2↑
24 98
y 25g×19.6%
| 24 |
| y |
| 98 |
| 25g×19.6% |
y=1.2g<3g,故酸完全反应;
③设25g质量分数为19.6% 的稀硫酸与钠恰好完全反应消耗钠的质量为z
2Na+H2SO4 =Na2SO4 +H2↑
46 98
z 25g×19.6%
| 46 |
| z |
| 98 |
| 25g×19.6% |
z=2.3g<3g,所以硫酸能够完全反应,由于剩余的钠还能够和水反应生成氢气,故生成氢气质量关系为:钠>镁>锌(镁锌的氢气来源于酸中的氢,而钠生成的氢气含有酸中的氢和反应的水中的部分分氢);
故选C
点评:此题是一道综合计算分析题,解题的关键是对物质反应中过量问题的讨论,是一道对学生处理问题的综合能力考查题.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目