摘要:30.⑴CaO+H2O=Ca(OH)2 ⑵CaCO3CaO+CO2↑ ⑶Fe+2HCl==== FeCl2+H2↑ ⑷Na2CO3+Ca(OH)2====CaCO2↓+2NaOH
网址:http://m.1010jiajiao.com/timu3_id_90341[举报]
(2013?泰州一模)下列框图中的物质均为初中化学常见的物质,其中A是大理石的主要成分,B属于氧化物,下图是它们之间的相互转化关系.
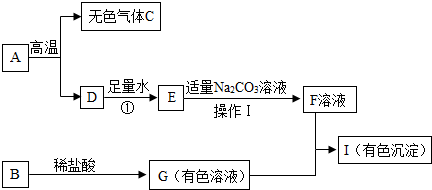
请回答:
(1)操作Ⅰ的名称为:
(2)A物质中所含阳离子的符号为
(3)反应①的化学方程式为
(4)若I是红褐色沉淀,请写出G 与F 反应的化学方程式:
查看习题详情和答案>>

请回答:
(1)操作Ⅰ的名称为:
过滤
过滤
;(2)A物质中所含阳离子的符号为
Ca2+
Ca2+
,物质C的化学式为CO2
CO2
;(3)反应①的化学方程式为
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
,该反应为放热
放热
(填“吸热”或“放热”)反应;(4)若I是红褐色沉淀,请写出G 与F 反应的化学方程式:
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
.已知干燥剂“碱石灰”的成份是:CaO和NaOH,在潮湿的空气中极易变质.某小组的同学对实验室中一瓶放置已久的“碱石灰”进行了如下的探究:
(1)甲同学猜想:样品只与空气中的水蒸汽发生了作用,则NaOH会潮解,CaO会变质,其反应的方程式为
(2)乙同学猜想:样品中含有Na2CO3,且还含有Ca(OH)2、CaCO3中的一种,并进行了如图所示的实验:
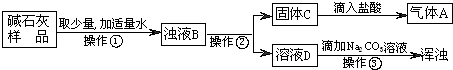
操作①、②都要用到玻璃棒,其中操作①玻璃棒的作用是
(3)从操作③的现象分析,样品中肯定还含有
(4)溶液D中一定含有的阳离子是(填离子符号)
查看习题详情和答案>>
(1)甲同学猜想:样品只与空气中的水蒸汽发生了作用,则NaOH会潮解,CaO会变质,其反应的方程式为
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
(2)乙同学猜想:样品中含有Na2CO3,且还含有Ca(OH)2、CaCO3中的一种,并进行了如图所示的实验:

操作①、②都要用到玻璃棒,其中操作①玻璃棒的作用是
加速溶解
加速溶解
,图中操作②的名称是过滤
过滤
(3)从操作③的现象分析,样品中肯定还含有
氢氧化钙
氢氧化钙
,其发生化学反应的方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(4)溶液D中一定含有的阳离子是(填离子符号)
Ca2+
Ca2+
.(2005?荔湾区二模)某同学在实验室做了如下实验:
取一药匙氧化钙粉末放入一洁净的烧杯中,加入适量水,用玻璃棒搅拌,放置至溶液变澄清
(1)写出有关反应的化学方程式
(2)若选用紫色石蕊试纸来确定上层清液的酸碱性,其操作方法是:
(3)设计一个简单的实验方案,鉴定上层清液中的溶质成份,请简述操作步骤、实验现象和结论:
查看习题详情和答案>>
取一药匙氧化钙粉末放入一洁净的烧杯中,加入适量水,用玻璃棒搅拌,放置至溶液变澄清
(1)写出有关反应的化学方程式
CaO+H2O═Ca(OH)2
CaO+H2O═Ca(OH)2
;(2)若选用紫色石蕊试纸来确定上层清液的酸碱性,其操作方法是:
撕取试纸少许放在白瓷板或玻璃片上,用玻璃棒沾取上层清液一滴与试纸接触,观察其颜色变化
撕取试纸少许放在白瓷板或玻璃片上,用玻璃棒沾取上层清液一滴与试纸接触,观察其颜色变化
;(3)设计一个简单的实验方案,鉴定上层清液中的溶质成份,请简述操作步骤、实验现象和结论:
取少量上层清液置于试管中,滴加无色酚酞试液,试液变红,证明溶液中含有OH-;②再取少量上层清液置于试管中,滴加Na2CO3溶液,产生白色沉淀,证明有Ca2+.由此可知,上层清液中的溶质是Ca(OH)2
取少量上层清液置于试管中,滴加无色酚酞试液,试液变红,证明溶液中含有OH-;②再取少量上层清液置于试管中,滴加Na2CO3溶液,产生白色沉淀,证明有Ca2+.由此可知,上层清液中的溶质是Ca(OH)2
.25、大海是取之不尽的化工原料宝库,从海水中可提取各项化工原料,下图是工业对海水进行几项综合利用的示意图,根据图示填空:

(1)在滤液(含氯化镁)中加入生石灰制取氢氧化镁时所发生反应的化学方程式:
(2)某课外化学活动小组取海水,蒸发、结晶,然后过滤,得到粗盐,过滤时,必须用到的玻璃仪器有
(3)若粗盐中尚存在CaCl2等杂质,为了除去CaCl2,可在“精制饱和食盐水”时加入过量的
查看习题详情和答案>>

(1)在滤液(含氯化镁)中加入生石灰制取氢氧化镁时所发生反应的化学方程式:
CaO+H2O=Ca(OH)2
、Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2
(2)某课外化学活动小组取海水,蒸发、结晶,然后过滤,得到粗盐,过滤时,必须用到的玻璃仪器有
漏斗、烧杯、玻璃棒
.(3)若粗盐中尚存在CaCl2等杂质,为了除去CaCl2,可在“精制饱和食盐水”时加入过量的
Na2CO3
(写化学式)溶液,再过滤,并加入适量的稀盐酸
(填试剂名称)即可;如果井水或溪水中含有的Ca2+、Mg2+较多,这种水称作硬水
,日常生活中降低水中Ca2+、Mg2+的方法是煮沸
.28、海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图:
(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是
查看习题详情和答案>>
(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式
CaO+H2O═Ca(OH)2
.(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒
不可以
,理由是
碳酸钠既可以将钙离子沉淀,又可以将多余的钡离子沉淀.
;(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是
除去多余的氢氧化钠和碳酸钠
.