题目内容
(2013?泰州一模)下列框图中的物质均为初中化学常见的物质,其中A是大理石的主要成分,B属于氧化物,下图是它们之间的相互转化关系.
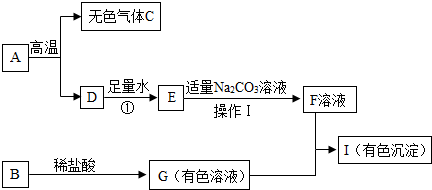
请回答:
(1)操作Ⅰ的名称为:
(2)A物质中所含阳离子的符号为
(3)反应①的化学方程式为
(4)若I是红褐色沉淀,请写出G 与F 反应的化学方程式:

请回答:
(1)操作Ⅰ的名称为:
过滤
过滤
;(2)A物质中所含阳离子的符号为
Ca2+
Ca2+
,物质C的化学式为CO2
CO2
;(3)反应①的化学方程式为
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
,该反应为放热
放热
(填“吸热”或“放热”)反应;(4)若I是红褐色沉淀,请写出G 与F 反应的化学方程式:
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
.分析:本题的突破口为:A为大理石的主要成分,所以A为碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,所以D为氧化钙,无色气体C为二氧化碳,D与足量的水反应生成了E,所以可以判断E为氢氧化钙,氢氧化钙可以和碳酸钠溶液反应生成F溶液,所以可以判断F为氢氧化钠溶液;B为氧化物,可以和稀盐酸反应生成有色溶液G,所以可以为氧化铜或氧化铁,那么G就可以是氯化铜或氯化铁溶液,所以I为氢氧化铜或氢氧化铁,至此各物质均已鉴定完毕,代入验证符合题意,可以据此答题.
解答:解:A为大理石的主要成分,所以A为碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,所以D为氧化钙,无色气体C为二氧化碳,D与足量的水反应生成了E,所以可以判断E为氢氧化钙,氢氧化钙可以和碳酸钠溶液反应生成F溶液,所以可以判断F为氢氧化钠溶液;B为氧化物,可以和稀盐酸反应生成有色溶液G,所以可以为氧化铜或氧化铁,那么G就可以是氯化铜或氯化铁溶液,所以I为氢氧化铜或氢氧化铁
(1)由上述分析可知E为石灰水,石灰水和碳酸钠反应生成碳酸钙沉淀和氢氧化钠溶液,固体与液体分离用过滤操作.
(2)由上述分析可知A为碳酸钙,阳离子为钙离子,符号为Ca2+,无色气体C为二氧化碳,化学式为CO2;
(3)反应①是氧化钙与水反应生成氢氧化钙,化学方程式为CaO+H2O=Ca (OH)2,该反应放出大量的热.
(4)I是红褐色沉淀,故I为Fe(OH)3,F为氢氧化钠溶液,因此G为氯化铁溶液,氯化铁与氢氧化钠反应生成氢氧化铁沉淀和氯化钠,化学方程式为3NaOH+FeCl3=Fe(OH)3↓+3NaCl
故答案为:(1)过滤
(2)Ca2+ CO2;
(3)CaO+H2O=Ca (OH)2 放热
(4)3NaOH+FeCl3=Fe(OH)3↓+3NaCl
(1)由上述分析可知E为石灰水,石灰水和碳酸钠反应生成碳酸钙沉淀和氢氧化钠溶液,固体与液体分离用过滤操作.
(2)由上述分析可知A为碳酸钙,阳离子为钙离子,符号为Ca2+,无色气体C为二氧化碳,化学式为CO2;
(3)反应①是氧化钙与水反应生成氢氧化钙,化学方程式为CaO+H2O=Ca (OH)2,该反应放出大量的热.
(4)I是红褐色沉淀,故I为Fe(OH)3,F为氢氧化钠溶液,因此G为氯化铁溶液,氯化铁与氢氧化钠反应生成氢氧化铁沉淀和氯化钠,化学方程式为3NaOH+FeCl3=Fe(OH)3↓+3NaCl
故答案为:(1)过滤
(2)Ca2+ CO2;
(3)CaO+H2O=Ca (OH)2 放热
(4)3NaOH+FeCl3=Fe(OH)3↓+3NaCl
点评:本题为框图式推断题,解题关键是找准解题的突破口,并从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目