摘要:在反应X→H2O+CO2中.X一定含有 元素.
网址:http://m.1010jiajiao.com/timu3_id_89872[举报]
如图所示,已知物质X是一种含钠元素的化合物,其余四种物质在一定条件下都可以转化成X.试推断:

(1)物质X的化学式为
(2)写出其中既有X且又有气体生成的反应的化学方程式
(3)图中所有生成X的化学反应的反应类型均是
查看习题详情和答案>>

(1)物质X的化学式为
NaNO3
NaNO3
;(2)写出其中既有X且又有气体生成的反应的化学方程式
Na2CO3+2HNO3=2NaNO3+CO2↑+H2O
Na2CO3+2HNO3=2NaNO3+CO2↑+H2O
;(3)图中所有生成X的化学反应的反应类型均是
复分解
复分解
反应.(2013?房山区二模)有限的元素可组成种类繁多的物质.依据表中的元素回答下列问题.
(1)A为氧化物,可用于制备改良酸性土壤的碱,A的化学式为
(2)B、C均为液体,且含同种元素,C在一定条件下可以生成B.该反应的化学方程式为
(3)D用于玻璃、造纸、纺织、洗涤剂的生产.向E溶液中滴加2~3滴紫色石蕊溶液,溶液变红,再滴加D溶液至溶液变蓝,此时
溶液中的溶质是
(4)现有一包固体粉末,可能由A、D和G(G为一种常见沉淀)中的一种或几种组成.为确定其组成,进行了如图的实验(假设实验过程无损耗).
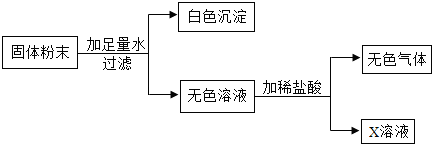
若实验取固体粉末20g,生成白色沉淀10g,最后得到溶质质量分数为5.85%的X溶液200g(只含一种溶质),则固体粉末的组成是
查看习题详情和答案>>
| 元素名称 | 氢 | 碳 | 氧 | 氯 | 钠 | 钙 |
| 元素符号 | H | C | O | Cl | Na | Ca |
CaO
CaO
.(2)B、C均为液体,且含同种元素,C在一定条件下可以生成B.该反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,此反应属于基本反应类型中的
| ||
分解
分解
反应.(3)D用于玻璃、造纸、纺织、洗涤剂的生产.向E溶液中滴加2~3滴紫色石蕊溶液,溶液变红,再滴加D溶液至溶液变蓝,此时
溶液中的溶质是
NaCl 和NaOH
NaCl 和NaOH
.写出反应方程式Na2CO 3+2HCl═2NaCl+H2O+CO2↑
Na2CO 3+2HCl═2NaCl+H2O+CO2↑
.(4)现有一包固体粉末,可能由A、D和G(G为一种常见沉淀)中的一种或几种组成.为确定其组成,进行了如图的实验(假设实验过程无损耗).

若实验取固体粉末20g,生成白色沉淀10g,最后得到溶质质量分数为5.85%的X溶液200g(只含一种溶质),则固体粉末的组成是
Na2CO 3、CaCO3和CaO
Na2CO 3、CaCO3和CaO
(写化学式).探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验.
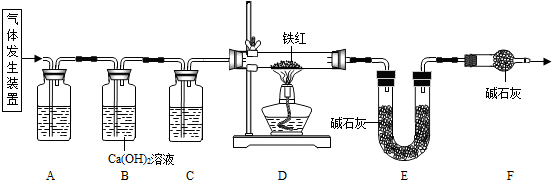
试回答:
【查阅资料】草酸晶体(H2C2O4?3H2O)在浓H2SO4作用下受热分解生成CO2和CO.
(1)实验前应先
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是
(4)某同学认为图示装置有不足之处,改进的方法是
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+y H2
x Fe+y H2O,Fe3C+2H2
3Fe+CH4.
(1)写出焙烧中氧化铁与CO反应的化学方程式:
(2)焙烧中加焦炭的作用除了可以生成CO外,还能
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.
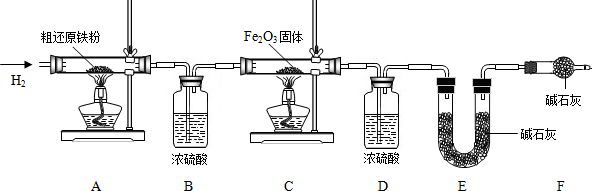
已知3CH4+4Fe2O3
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②点燃A处酒精灯;
③缓缓通入纯净干燥的H2;
④点燃C处酒精灯;
⑤分别熄灭A处、C处酒精灯;
⑥再缓缓通入少量H2;
⑦再次称量必要装置的质量.
操作的先后顺序是①→③→
A.②→④B.④→②
(4)步骤③的目的是
(5)若缺少装置D,则所测氧元素的质量分数将
(6)粗还原铁粉样品的质量为20.000g,装置B、E分别增重0.360g和0.440g,则计算样品出中碳元素的质量分数是
查看习题详情和答案>>

试回答:
【查阅资料】草酸晶体(H2C2O4?3H2O)在浓H2SO4作用下受热分解生成CO2和CO.
(1)实验前应先
检查装置的气密性
检查装置的气密性
.(2)进入D中的气体是纯净、干燥的CO,则A中试剂是
c
c
、C中的试剂是a
a
(填字母编号).a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是
防止空气中二氧化碳、水蒸气进入E装置中
防止空气中二氧化碳、水蒸气进入E装置中
.(4)某同学认为图示装置有不足之处,改进的方法是
在F后用酒精灯点燃
在F后用酒精灯点燃
.探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+y H2
| ||
| ||
(1)写出焙烧中氧化铁与CO反应的化学方程式:
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(2)焙烧中加焦炭的作用除了可以生成CO外,还能
提供热量
提供热量
.【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.

已知3CH4+4Fe2O3
| ||
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②点燃A处酒精灯;
③缓缓通入纯净干燥的H2;
④点燃C处酒精灯;
⑤分别熄灭A处、C处酒精灯;
⑥再缓缓通入少量H2;
⑦再次称量必要装置的质量.
操作的先后顺序是①→③→
B
B
→⑤→⑥→⑦(填字母)A.②→④B.④→②
(4)步骤③的目的是
除去装置内的氧气,防止发生爆炸
除去装置内的氧气,防止发生爆炸
,验证该步骤目的达到的实验方法是收集尾气靠近燃着的酒精灯,听声音
收集尾气靠近燃着的酒精灯,听声音
;(5)若缺少装置D,则所测氧元素的质量分数将
不变
不变
(填“偏大’’“偏小“或“不变“,下同).(6)粗还原铁粉样品的质量为20.000g,装置B、E分别增重0.360g和0.440g,则计算样品出中碳元素的质量分数是
0.6%
0.6%
,氧元素的质量分数是1.6%
1.6%
.(无需计算过程).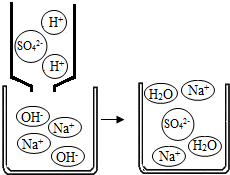 (2013?建邺区一模)氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.
(2013?建邺区一模)氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的
开头
开头
(填“开头”、“中间”或“结尾”).NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是
OH-
OH-
(填离子符号).Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易
吸水潮解
吸水潮解
,因此它与生石灰一起用作某些气体的干燥剂(2)如右图所示,NaOH溶液可与稀酸反应的方程式为
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的
d
d
.a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究.
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
(用方程式表示);猜想Ⅲ:全部变质
【实验设计、现象和推断】
| 实验步骤 | 实验现象 |
| ①取少量白色固体于试管中,加水振荡后,至全部溶解 | 无色溶液 |
| ②向试管的溶液中滴加适量物质X的溶液 | 现象A |
| ③再向试管中滴加几滴酚酞试液. | 现象B |
稀盐酸
稀盐酸
,说明猜想I
I
可排除.(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验
不能
不能
(填“能”或“不能”)说明猜想Ⅱ成立.(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是
现象A有白色沉淀产生,现象B溶液变成红色
现象A有白色沉淀产生,现象B溶液变成红色
.(4)定量研究:根据上述实验,可通过测定
产生气体的质量或产生白色沉淀的质量
产生气体的质量或产生白色沉淀的质量
,再通过计算得到氢氧化钠的变质情况.密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是
|
物质 |
X |
O2 |
CO2 |
H2O |
|
反应前质量/g |
16 |
70 |
1 |
0 |
|
反应后质量/g |
0 |
待测 |
45 |
36 |
A.该反应为分解反应 B.X中一定含有碳、氢两种元素
C.表中“待测”值为5 D.反应生成的CO2和H2O的质量比为45:36
查看习题详情和答案>>