摘要:6.解:设参加反应的NaOH的质量为x.反应生成的NaCl的质量为y. NaOH + Hcl → NaCl + H2O 40 36.5 58.5 x 73克×10% y ⑴NaOH溶液中溶质的质量分数为: ⑵溶液的质量: 溶剂的质量: ∴20℃时NaCl的溶解度S为:∶∶S S 答:略 B组题
网址:http://m.1010jiajiao.com/timu3_id_89722[举报]
分析:H2SO4和BaCl2反应生成BaSO4和HCl,再用NaOH中和剩余H2SO4时,不能忽视NaOH又和生成HCl发生反应的这个隐蔽反应,而且这个反应是解题时不走弯路的关键。
【常规解法】(l)设BaCl2消耗H2SO4的质量为x,反应生成HCl的质量为y
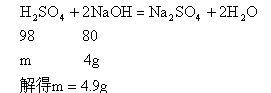 (2)设HCl消耗NaOH的质量为z
(2)设HCl消耗NaOH的质量为z
在反应中共消耗NaOH质量为32g×25%=8g,中和HCl用去4g,尚余4g
 (3)设4gNaOH中和的H2SO4质量为m
(3)设4gNaOH中和的H2SO4质量为m
硫酸中溶质的质量分数为
 答案:(略)
答案:(略)
【解法二】此题稍加分析,即可一步解出:用BaCl2的量不能求出H2SO4的量是因BaCl2不足量,而用NaOH的量却可求出H2SO4的量,因二者是完全中和的反应。之所以可用NaOH 而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
设:H2SO4的量为x

硫酸中溶质的质量分数为 答案:(略)
答案:(略)
(2013?镇江模拟)兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示: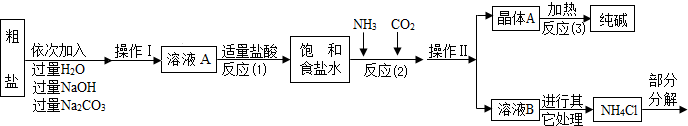
【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式
②操作Ⅱ的名称为
③反应(1)中加适量盐酸的作用是
④反应(2)中为提高产率,所加气体的顺序是
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

【组成探究二】
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
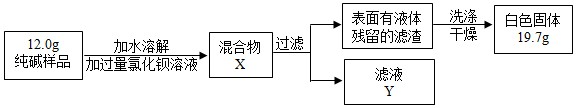
①判断加入BaCl2溶液是否过量的合适方法是
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为
查看习题详情和答案>>
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
| ||
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式
2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
.②操作Ⅱ的名称为
过滤
过滤
.③反应(1)中加适量盐酸的作用是
除去过量的氢氧化钠和碳酸钠
除去过量的氢氧化钠和碳酸钠
.④反应(2)中为提高产率,所加气体的顺序是
B
B
(填字母).A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是
D
D
(填字母).A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑;
| ||
2NaHCO3
Na2CO3+H2O+CO2↑;
.
| ||
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
AB AB |
B中澄清石灰水不变浑浊 B中澄清石灰水不变浑浊 |
样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为
AgNO3+NaCl═AgCl↓+NaNO3
AgNO3+NaCl═AgCl↓+NaNO3
,确定纯碱样品含有杂质NaCl.【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是
A
A
,观察现象判断.A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加
BC
BC
,观察现象判断.A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为
88.3%
88.3%
(写出计算过程)
为测定某药片中CaCO3含量,化学兴趣小组设计以下两种方案(药片中其他成分与HCl和NaOH溶液均不反应).请回答有关问题:
方案一:利用CO2的体积测定CaCO3的含量
(1)装置B的目的是除去CO2中少量HCl(气),其中发生的反应的化学方程式是 .
(2)装置A中连通管X的作用是 .
(3)通常在装置B中加入少量植物油,目的是 .
方案二:利用酸碱中和滴定法测定
实验步骤:
取一粒0.1g药片研碎,加入适量蒸馏水,再用一定质量、一定质量分数的足量HCl溶液溶解,充分反应后,滴加酚酞作指示剂,再用一定质量分数NaOH溶液中和过量的HCl溶液.
(4)当最后一滴NaOH溶液滴入时,溶液的颜色由 色变为 色,且半分钟内不褪去,即完全中和.
(5)进行含量测定除了样品质量外,还需要的数据有 (填字母序号)
A.HCl溶液和NaOH溶液的质量分数 B.参加反应的HCl溶液和NaOH溶液的体积
C.HCl溶液和NaOH溶液的密度 D.中和滴定所需要的时间.
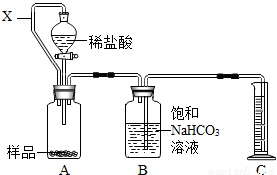 查看习题详情和答案>>
查看习题详情和答案>>
方案一:利用CO2的体积测定CaCO3的含量
(1)装置B的目的是除去CO2中少量HCl(气),其中发生的反应的化学方程式是 .
(2)装置A中连通管X的作用是 .
(3)通常在装置B中加入少量植物油,目的是 .
方案二:利用酸碱中和滴定法测定
实验步骤:
取一粒0.1g药片研碎,加入适量蒸馏水,再用一定质量、一定质量分数的足量HCl溶液溶解,充分反应后,滴加酚酞作指示剂,再用一定质量分数NaOH溶液中和过量的HCl溶液.
(4)当最后一滴NaOH溶液滴入时,溶液的颜色由 色变为 色,且半分钟内不褪去,即完全中和.
(5)进行含量测定除了样品质量外,还需要的数据有 (填字母序号)
A.HCl溶液和NaOH溶液的质量分数 B.参加反应的HCl溶液和NaOH溶液的体积
C.HCl溶液和NaOH溶液的密度 D.中和滴定所需要的时间.
 查看习题详情和答案>>
查看习题详情和答案>>
兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:
【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式______.
②操作Ⅱ的名称为______.
③反应(1)中加适量盐酸的作用是______.
④反应(2)中为提高产率,所加气体的顺序是______(填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是______(填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为______.
②设计实验检验纯碱样品中是否混有晶体A请完成下表:
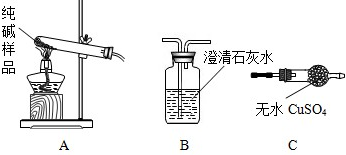
| 选择的装置 | 实验现象 | 实验结论 |
| ______ | ______ | 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为______,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是______,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加______,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为______ (写出计算过程) 查看习题详情和答案>>
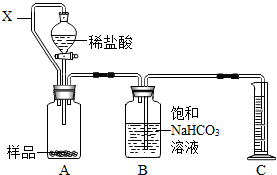 (2012?江宁区二模)为测定某药片中CaCO3含量,化学兴趣小组设计以下两种方案(药片中其他成分与HCl和NaOH溶液均不反应).请回答有关问题:
(2012?江宁区二模)为测定某药片中CaCO3含量,化学兴趣小组设计以下两种方案(药片中其他成分与HCl和NaOH溶液均不反应).请回答有关问题:方案一:利用CO2的体积测定CaCO3的含量
(1)装置B的目的是除去CO2中少量HCl(气),其中发生的反应的化学方程式是
NaHCO3+HCl=NaCl+CO2↑+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O
.(2)装置A中连通管X的作用是
保持漏斗与广口瓶中压强相等,使HCl顺利下滴
保持漏斗与广口瓶中压强相等,使HCl顺利下滴
. (3)通常在装置B中加入少量植物油,目的是
防止CO2溶解于水
防止CO2溶解于水
.方案二:利用酸碱中和滴定法测定
实验步骤:
取一粒0.1g药片研碎,加入适量蒸馏水,再用一定质量、一定质量分数的足量HCl溶液溶解,充分反应后,滴加酚酞作指示剂,再用一定质量分数NaOH溶液中和过量的HCl溶液.
(4)当最后一滴NaOH溶液滴入时,溶液的颜色由
无
无
色变为红
红
色,且半分钟内不褪去,即完全中和.(5)进行含量测定除了样品质量外,还需要的数据有
ABC
ABC
(填字母序号)A.HCl溶液和NaOH溶液的质量分数 B.参加反应的HCl溶液和NaOH溶液的体积
C.HCl溶液和NaOH溶液的密度 D.中和滴定所需要的时间.