摘要:工业上用石灰石.碳酸钠.水为原料可以制取烧碱.写出有关反应的化学方程式: . . . 思路解析:制备烧碱的原理方程式是Ca(OH)2+Na2CO3====2NaOH+CaCO3↓.这就需要纯碱和消石灰.而制备消石灰则需要CaO固体.制备CaO固体则依靠煅烧石灰石. 答案:CaCO3CaO+CO2↑ CaO+H2O====Ca(OH)2 Ca(OH)2+Na2CO3====2NaOH+CaCO3↓
网址:http://m.1010jiajiao.com/timu3_id_89204[举报]
工业上用石灰石、碳酸钠、水为原料可以制取烧碱,写出有关反应的化学方程式:_____________________ 、______________________ 、___________________________ 。
查看习题详情和答案>>
 23、碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.
23、碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.①碳酸钠的化学式是Na2CO3,俗称
纯碱
,其水溶液呈碱性
性;工业上用熟石灰与碳酸钠反应制取氢氧化钠,有关的化学方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
,碳酸钠晶体的化学式是Na2CO3?10H2O,0.2mol碳酸钠晶体中有水2
mol;②在某温度时,取两份等质量、等浓度的不饱和碳酸钠溶液,分别加入mg碳酸钠粉末和ng碳酸钠晶体,均能使溶液达到饱和,如图:其中属于加入碳酸钠粉末的曲线是
(1)
.(填(1)、(2))
③综合上述各小题信息,可以估算出,此温度下碳酸钠饱和溶液溶质的质量分数为
小于
(等于37%、大于37%、小于37%).工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:
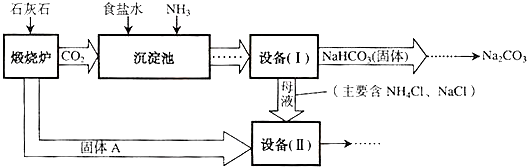
(1)NaHCO3俗称
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
(3)写出设备( II)中发生的复分解反应的方程式
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
请回答下列问题:
①石灰石完全反应后生成二氧化碳的质量为
②该石灰石样品中碳酸钙的质量分数,写出计算过程.
查看习题详情和答案>>

(1)NaHCO3俗称
小苏打
小苏打
,该物质受热分解成碳酸钠和两种氧化物,写出反应的化学方程式2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
,还可以用来治疗胃酸过多,反应方程式是
| ||
NaHCO3+HCl═NaCl+H2O+CO2↑
NaHCO3+HCl═NaCl+H2O+CO2↑
.(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
过滤
过滤
.(3)写出设备( II)中发生的复分解反应的方程式
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
.(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
NaCl、NH3
NaCl、NH3
(填写化学式).(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
| 反应时间 | T0 | T1 | T2 | T3 | T4 | T5 | T6 |
| 反应后固体的质量 | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
①石灰石完全反应后生成二氧化碳的质量为
22
22
克.②该石灰石样品中碳酸钙的质量分数,写出计算过程.