题目内容
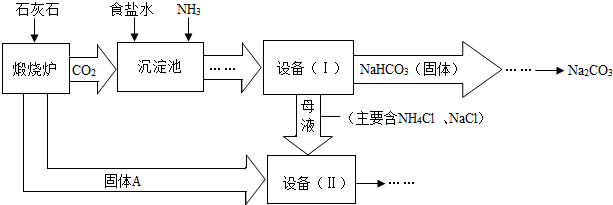
工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:
(1)NaHCO3俗称
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
(3)写出设备( II)中发生的复分解反应的方程式
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
请回答下列问题:
①石灰石完全反应后生成二氧化碳的质量为
②该石灰石样品中碳酸钙的质量分数,写出计算过程.

(1)NaHCO3俗称
小苏打
小苏打
,该物质受热分解成碳酸钠和两种氧化物,写出反应的化学方程式2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
,还可以用来治疗胃酸过多,反应方程式是
| ||
NaHCO3+HCl═NaCl+H2O+CO2↑
NaHCO3+HCl═NaCl+H2O+CO2↑
.(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
过滤
过滤
.(3)写出设备( II)中发生的复分解反应的方程式
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
.(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
NaCl、NH3
NaCl、NH3
(填写化学式).(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
| 反应时间 | T0 | T1 | T2 | T3 | T4 | T5 | T6 |
| 反应后固体的质量 | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
①石灰石完全反应后生成二氧化碳的质量为
22
22
克.②该石灰石样品中碳酸钙的质量分数,写出计算过程.
分析:(1)根据反应物、生成物及反应条件写出反应的方程式,可以据此完成解答;
(2)根据过滤的原理和适用范围回答;
(3)根据氧化钙的性质及母液的成分分析发生的反应,从而判断反应类型;
(4)根据“设备(Ⅱ)”中发生的反应和流程图中可循环使用的物质种类回答;
(5)煅烧石灰石时碳酸钙分解放出二氧化碳而使反应后固体质量减小,直到碳酸钙完全分解,剩余固体质量不再改变;利用质量守恒定律,由反应前后固体质量差计算出反应放出二氧化碳的质量,然后由反应的化学方程式,利用放出二氧化碳的质量求得石灰石样品中所含碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.
(2)根据过滤的原理和适用范围回答;
(3)根据氧化钙的性质及母液的成分分析发生的反应,从而判断反应类型;
(4)根据“设备(Ⅱ)”中发生的反应和流程图中可循环使用的物质种类回答;
(5)煅烧石灰石时碳酸钙分解放出二氧化碳而使反应后固体质量减小,直到碳酸钙完全分解,剩余固体质量不再改变;利用质量守恒定律,由反应前后固体质量差计算出反应放出二氧化碳的质量,然后由反应的化学方程式,利用放出二氧化碳的质量求得石灰石样品中所含碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.
解答:解:(1)NaHCO3俗称小苏打,碳酸氢钠受热时生成碳酸钠、水和二氧化碳,该反应的化学方程式是:2NaHCO3
Na2CO3+CO2↑+H2O;碳酸氢钠还可以用来治疗胃酸过多,反应方程式是NaHCO3+HCl═NaCl+H2O+CO2↑.
故答案为:小苏打;2NaHCO3
Na2CO3+CO2↑+H2O;NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,“设备(I)”中的液体混合物中分离出析出的晶体,可用过滤的方法;
故答案为:过滤;
(3)氧化钙与水反应生成氢氧化钙,氢氧化钙可以和母液中的氯化铵反应生成氨气、水和氯化钙,后者属于复分解反应,反应的方程式Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2.
故答案为:Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2;
(4)结合(3)的解答可以知道,进入“设备(Ⅱ)”的物质有氧化钙、氯化钠、氯化铵及水,发生的反应有H2O+CaO═Ca(OH)2和Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2,最终产物有氯化钠、氯化钙、氨气,其中氯化钠、氨气可再利用;
故答案为:NaCl、NH3;
(5)①由实验记录数据可知,在反应进行至t5时,继续煅烧剩余固体质量不再减小,说明碳酸钙已完全分解,根据质量守恒定律,生成二氧化碳的质量=80g-58g=22g;
故答案为:22;
②设80g石灰石中含CaCO3的质量为x,
CaCO3
CaO+CO2↑
100 44
x 22g
=
,解得x=50g
石灰石中CaCO3的质量分数为:
×100%=62.5%.
答:该石灰石中CaCO3的质量分数为62.5%.
| ||
故答案为:小苏打;2NaHCO3
| ||
(2)过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,“设备(I)”中的液体混合物中分离出析出的晶体,可用过滤的方法;
故答案为:过滤;
(3)氧化钙与水反应生成氢氧化钙,氢氧化钙可以和母液中的氯化铵反应生成氨气、水和氯化钙,后者属于复分解反应,反应的方程式Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2.
故答案为:Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2;
(4)结合(3)的解答可以知道,进入“设备(Ⅱ)”的物质有氧化钙、氯化钠、氯化铵及水,发生的反应有H2O+CaO═Ca(OH)2和Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2,最终产物有氯化钠、氯化钙、氨气,其中氯化钠、氨气可再利用;
故答案为:NaCl、NH3;
(5)①由实验记录数据可知,在反应进行至t5时,继续煅烧剩余固体质量不再减小,说明碳酸钙已完全分解,根据质量守恒定律,生成二氧化碳的质量=80g-58g=22g;
故答案为:22;
②设80g石灰石中含CaCO3的质量为x,
CaCO3
| ||
100 44
x 22g
| 100 |
| 44 |
| x |
| 22g |
石灰石中CaCO3的质量分数为:
| 50g |
| 80g |
答:该石灰石中CaCO3的质量分数为62.5%.
点评:化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,学习中要理解掌握其生产流程、原理、反应方程式等内容.

练习册系列答案
相关题目