摘要:11.下表为元素周期表的一部分.请参照元素①-⑧在表中的位置.用化学用语回答下列问题: (1)④.⑤.⑥的原子半径由大到小的顺序是 . (2)②.③.⑦的最高价含氧酸的酸性由强到弱的顺序是 . (3)①.④.⑤.⑧中的某些元素可形成既含离子键又含极性共价键的化合物.写出其中一种化合物的电子式: . (4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解.可使用的催化剂为 . a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 (5)由表中元素形成的常见物质X.Y.Z.M.N可发生以下反应: X溶液与Y溶液反应的离子方程式为 . N→⑥的单质的化学方程式为 . 常温下.为使0.1 mol/L M溶液中由M电离的阴.阳离子浓度相等.应向溶液中加入一定量的Y溶液至 . [解析] 由各元素在周期表中的位置可判断①是H.②是C.③是N.④是O.⑤是Na.⑥是Al.⑦是Si.⑧是Cl. (1)O.Na.Al原子半径由元素周期律可知半径由大到小的顺序是:Na>Al>O.(2)C.N.Si最高价含氧酸的酸性由强到弱的顺序是:HNO3>H2CO3>H2SiO3.(3)H.O.Na.Cl元素中的某些元素形成的既含离子键又含极性共价键的化合物可以是NaOH.NaClO等.(4)由表中两种元素的原子按1∶1组成的常见液态化合物为H2O2.它可被MnO2或一些重金属离子催化分解.故选a.b.(5)⑥的单质是Al.由转化关系可推Z是Al(OH)3.N是Al2O3,M是仅含非金属元素的盐.则为铵盐.结合表中元素可推X.Y是铝盐和氨:AlCl3与NH3.M是NH4Cl.要使NH4Cl溶液中NH与Cl-浓度相等.则应向溶液中加入一定量的氨水至溶液的pH等于7. [答案] HNO3>H2CO3>H2SiO3
网址:http://m.1010jiajiao.com/timu3_id_89000[举报]
下表为元素周期表的一部分,回答下列问题:
(1)写出元素符号:①
(2)若用M代表碱金属元素,则其最高价氧化物对应的水化物的化学式为
(3)在元素③与⑩中,化学性质较活泼的是
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
N
N
,④Mg
Mg
,⑥Si
Si
,⑦S
S
.(2)若用M代表碱金属元素,则其最高价氧化物对应的水化物的化学式为
MOH
MOH
;若用X表示卤族元素,则其气态氢化物的分子式为HX
HX
;元素②、⑧、(12)的气态氢化物的稳定性由强到弱的顺序为HF>HCl>HBr
HF>HCl>HBr
(填化学式).(3)在元素③与⑩中,化学性质较活泼的是
K
K
(填元素符号),写出用化学实验证明它较活泼的方法:钾与水的反应比钠与水的反应更剧烈
钾与水的反应比钠与水的反应更剧烈
.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: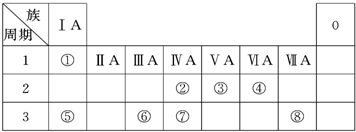
(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(如图):
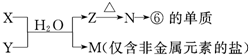
X溶液与Y溶液反应的离子方程式
N→⑥的单质的化学方程式为
M溶液中离子浓度由大到小的排列顺序是
M中阳离子的鉴定方法
查看习题详情和答案>>

(1)地壳中含量居于第二位的元素在周期表中的位置是
第三周期第IVA族
第三周期第IVA族
.(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
同一主族元素从上到下原子核外电子层数依次增多
同一主族元素从上到下原子核外电子层数依次增多
,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式


(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
c
c
.a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |

X溶液与Y溶液反应的离子方程式
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为
2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
,
| ||
| 冰晶石 |
M溶液中离子浓度由大到小的排列顺序是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,M中阳离子的鉴定方法
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
.(2009?天津)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序是
 .
.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 或
或
 或
或 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 C.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
查看习题详情和答案>>

(1)④、⑤、⑥的原子半径由大到小的顺序是
Na>Al>O
Na>Al>O
,⑧的阴离子结构示意图为

(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 或
或
 或
或
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
ab
ab
.a.MnO2 b.FeCl3 C.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
 4Al+3O2↑
4Al+3O2↑2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
,常温下,为使0.1mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 4Al+3O2↑
4Al+3O2↑溶液的pH等于7
溶液的pH等于7
.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑥、⑦的原子半径由小到大的顺序为
(2)②、③、⑧的最高价含氧酸的酸性由弱到强的顺序是
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,请写出该化合物的电子式
 结构式
结构式
(4)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
O<Si<Al
O<Si<Al
.(2)②、③、⑧的最高价含氧酸的酸性由弱到强的顺序是
H2CO3<HNO3<HClO4
H2CO3<HNO3<HClO4
.(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,请写出该化合物的电子式


H-O-O-H
H-O-O-H
.(4)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称
金刚石
金刚石
、石墨、足球烯或石墨烯
石墨、足球烯或石墨烯
.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)②的气态氢化物分子的结构式为
 .
.
(2)②、③的最高价含氧酸的酸性由强到弱的顺序是
(3)⑤、⑥元素的金属性强弱依次为
(4)④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式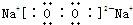
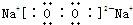 .
.
(5)写出②和⑦中稳定性高的气态氢化物的化学式
(6)用电子式表示⑤和⑨形成化合物的过程:
 .
.
查看习题详情和答案>>
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑨ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |


(2)②、③的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3
HNO3>H2CO3
.(填化学式)(3)⑤、⑥元素的金属性强弱依次为
减小
减小
.(填“增大”、“减小”、或“不变”)(4)④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式
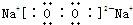
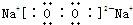
(5)写出②和⑦中稳定性高的气态氢化物的化学式
CH4
CH4
,写出④和⑧中沸点高的气态氢化物的化学式H2O
H2O
,沸点高的理由是水分子间形成氢键
水分子间形成氢键
.(6)用电子式表示⑤和⑨形成化合物的过程:

