网址:http://m.1010jiajiao.com/timu3_id_88928[举报]
(8分)标准状况下,向100 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
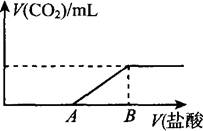
已知图中B点位置固定,V(B)=300 ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
|
V(A)的取值 |
V(A)=0 |
0<V(A)<150 |
V(A)=150 |
150<V(A)<300 |
|
溶质的成分 |
① |
② |
③ |
④ |
(3)取V(A)=100 mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是 。
查看习题详情和答案>>
(分)标准状况下,向100 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:

已知图中B点位置固定,V(B)=300 ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 | ① | ② | ③ | ④ |
(3)取V(A)=100 mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是 。
查看习题详情和答案>>向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是

A.原NaOH溶液的浓度为0.1 mol/L
B.通入CO2的体积为448 mL
C.所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3) = 1: 3
D.所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3) = 2: 1
查看习题详情和答案>>
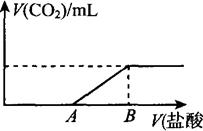
(8分)标准状况下,向1 00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
 k+s-5#u
k+s-5#u
已知图中B点位置固定,V(B)="300" ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 | ① | ② | ③ | ④ |
(8分)标准状况下,向100 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
已知图中B点位置固定,V(B)=300 ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 | ① | ② | ③ | ④ |
(3)取V(A)=100mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是 。
查看习题详情和答案>>