摘要:17.配制一定物质的量浓度的溶液是实验室进行科学研究的重要环节. (1)若配制大约1 mol·L-1的溶液100 mL.所给仪器只有托盘天平.量筒.带刻度的烧杯.玻璃棒.下列可选用的试剂是 . A.氢氧化钠固体 B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%) (2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时.将第一次洗涤液转移到容量瓶内的操作. 该步骤对所得溶液浓度的影响是 (填“偏高 .“偏低 或“无影响 ).原因是 . 中溶液时.该学生使用托盘天平称取碳酸钠.则与计算量一致吗?为什么? . [答案] 偏低 ①玻璃棒紧靠容量瓶口造成洗涤液外溢 ②玻璃棒从容量瓶移出时.残留在玻璃棒上的洗涤液可能滴在瓶外 ③玻璃棒移出后直接放在桌面上.造成残留洗涤液损失 ④玷污玻璃棒 (3)不一致.因为Na2CO3的计算量为1.06 g.而托盘天平只能准确到0.1 g.只能称取碳酸钠1.1 g
网址:http://m.1010jiajiao.com/timu3_id_88924[举报]
(2010?娄底模拟)下列实验操作会导致实验结果偏低的是( )
①配制100g 10%的CuSO4溶液,称取10g 硫酸铜晶体溶于90g水中
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2g,所得溶液的浓度
④用酸式滴定管量取用98%,密度为1.84g/cm3的浓H2SO4配制200mL 2mol?L-1的稀H2SO4时,先平视后仰视.
①配制100g 10%的CuSO4溶液,称取10g 硫酸铜晶体溶于90g水中
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2g,所得溶液的浓度
④用酸式滴定管量取用98%,密度为1.84g/cm3的浓H2SO4配制200mL 2mol?L-1的稀H2SO4时,先平视后仰视.
查看习题详情和答案>>
 Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
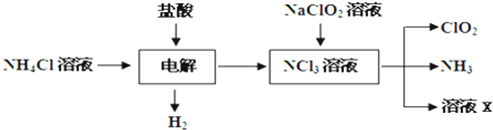
(1)写出电解时发生反应的化学方程式:
(2)除去ClO2中的NH3可选用的试剂是
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
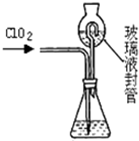
(3)测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
③测得ClO2的质量m(ClO2)=
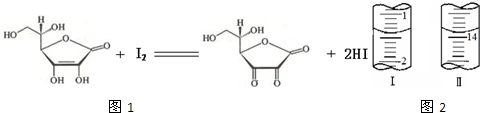
维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定.维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I- I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如图1所示:
(1)滴定选用
(2)待测维生素C溶液应在
A、0.1mol?L-1 CH3COOH B、0.1mol?L-1 HNO3 C、0.1mol?L-1 NaOH D、0.1mol?L-1 Na2SO3
(3)不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,其原因是
A.I2易升华,无法准确称量 B.I2易被空气氧化
C.I2的溶解度太小,无法制成溶液 D.加入的KI会影响滴定结果
(4)将1.0 g 维生素样品制成的100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图2,则样品中维生素C的质量分数为
查看习题详情和答案>>

(1)滴定选用
酸式
酸式
(填酸式或碱式)滴定管,滴定所用的指示剂为淀粉溶液
淀粉溶液
,出现溶液的蓝色刚好出现,保持半分钟不变色
溶液的蓝色刚好出现,保持半分钟不变色
现象时即为滴定终点.(2)待测维生素C溶液应在
酸性
酸性
(填酸性可碱性)介质中配制,可以选择试剂A
A
(填字母)A、0.1mol?L-1 CH3COOH B、0.1mol?L-1 HNO3 C、0.1mol?L-1 NaOH D、0.1mol?L-1 Na2SO3
(3)不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,其原因是
A
A
(填字母)A.I2易升华,无法准确称量 B.I2易被空气氧化
C.I2的溶解度太小,无法制成溶液 D.加入的KI会影响滴定结果
(4)将1.0 g 维生素样品制成的100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图2,则样品中维生素C的质量分数为
88%
88%
.