摘要:11.铅蓄电池的工作原理为:研读 右图.下列判断不正确的是 A.K 闭合时.d电极反应式: B.当电路中转移0.2mol电子时.I中消耗的为0.2 mol C.K闭合时.II中向c电极迁移 D.K闭合一段时间后.II可单独作为原电池.d电极为正极 [解析]答案:C 本题考查电化学的相关知识 K闭合时Ⅰ为电解池.Ⅱ为电解池.Ⅱ中发生充电反应.d电极为阳极发生氧化反应.其反应式为PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42- 所以A正确.在上述总反应式中.得失电子总数为2e-.当电路中转移0.2mol电子时.可以计算出Ⅰ中消耗的硫酸的量为0.2mol.所以B对.K闭合一段时间.也就是充电一段时间后Ⅱ可以作为原电池.由于c表面生成Pb.放电时做电源的负极.d表面生成PbO2.做电源的正极.所以D也正确.K闭合时d是阳极.阴离子向阳极移动.所以C错.
网址:http://m.1010jiajiao.com/timu3_id_88658[举报]
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
2PbSO4+2H2O,现设计如图1所示装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减小11.2g.请回答下列问题:
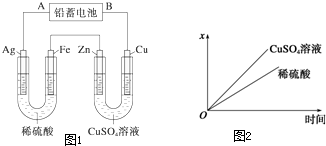
(1)A是铅蓄电池的
(2)Ag电极上的反应式为
(3)Cu电极上的反应式为
(4)如图2表示电解时某个量(纵坐标x)随时间变化的曲线,这个量x最有可能表示的是
a.两个U形管中析出的气体体积
b.两个U形管中阳极质量的减少量
c.两个U形管中阴极质量的增加量.
查看习题详情和答案>>
| 放电 | 充电 |

(1)A是铅蓄电池的
负
负
(填“正”或“负”)极,铅蓄电池的正极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O
PbO2+4H++SO42-+2e-═PbSO4+2H2O
.(2)Ag电极上的反应式为
2H++2e-═H2↑
2H++2e-═H2↑
,析出的物质共0.4
0.4
g.(3)Cu电极上的反应式为
Cu-2e-═Cu2+
Cu-2e-═Cu2+
,CuSO4溶液的浓度不变
不变
(填“减小”、“增大”或“不变”).(4)如图2表示电解时某个量(纵坐标x)随时间变化的曲线,这个量x最有可能表示的是
b
b
(填序号).a.两个U形管中析出的气体体积
b.两个U形管中阳极质量的减少量
c.两个U形管中阴极质量的增加量.
(8分)某同学用铅蓄电池作电源,用石墨做电极电解500 mL某浓度的CuSO4溶液,观察到A电极表面有红色固体物质生成,当溶液中原有溶质完全电解后,停止通电,取出A电极,洗涤、干燥、称量,电极增重1.6 g。已知铅蓄电池的工作原理为:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
请按要求回答下列问题:
(1)电解CuSO4溶液的化学方程式 ,
(2)当反应过程中转移的电子为0.02mol时,铅蓄电池内消耗硫酸的物质的量为 mol。
(3)电解前CuSO4溶液的物质的量浓度为 。
(4)若电解前后溶液的体积不变,电解后溶液的pH=
(5)写出铅蓄电池负极的电极反应式:
查看习题详情和答案>>
 铅蓄电池的工作原理为Pb+PbO2+2H2SO
铅蓄电池的工作原理为Pb+PbO2+2H2SO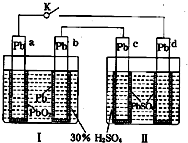 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( ) (2010?福建)铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( )
(2010?福建)铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( )