摘要:铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
网址:http://m.1010jiajiao.com/timu3_id_8845[举报]
(1)铁在氧气中燃烧:
(2)硫跟氧气反应:
(3)用过氧化氢与二氧化锰制氧气:
(4)
(5)
(6)
查看习题详情和答案>>
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
;
| ||
(2)硫跟氧气反应:
S+O2
SO2
| ||
S+O2
SO2
;
| ||
(3)用过氧化氢与二氧化锰制氧气:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
(4)
1
1
C3H8+5
5
O2
| ||
3
3
CO2+4
4
H2O;(5)
3
3
Mg+1
1
N2
| ||
1
1
Mg3N2(6)
4
4
FeS+7
7
O2
| ||
2
2
Fe2O3+4
4
SO2.铁在氧气中燃烧的化学方程式:
查看习题详情和答案>>
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.实验现象
| ||
剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体
剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体
.集气瓶中预先加少量水或沙的目的防止生成物熔化溅落下来炸裂集气瓶
防止生成物熔化溅落下来炸裂集气瓶
.做“铁丝在氧气中燃烧”的实验时,集气瓶底部要
查看习题详情和答案>>
预先铺上一层细沙或少量的水
预先铺上一层细沙或少量的水
,目的是防止生成物溅落下来炸裂集气瓶
防止生成物溅落下来炸裂集气瓶
,该化学反应的表达式为:3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
燃烧是生活中常常见到的现象,氧气具有支持燃烧的性质.(提示:假设蜡烛中不含氧元素)

(1)上述三个实验的共同点是
①都有光或火焰产生 ②都放热 ③生成物都为固体
④都是化合反应 ⑤都是氧化反应 ⑥生成物都是氧化物
(2)硫燃烧实验中水的作用是
(3)铁丝燃烧的化学反应式为
(4)从化学反应前后氧元素化合价的变化分析,氧气在上述反应中具有氧化性的原因是
(提出问题1)只有氧气才能支持燃烧吗?
(提示:钠是一种银白色金属.)
(设计实验一)向盛有Na的硬质玻璃管中通入纯净、干燥的CO2,当观察到澄清石灰水中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后玻璃管中有黑色颗粒和白色固体生成.
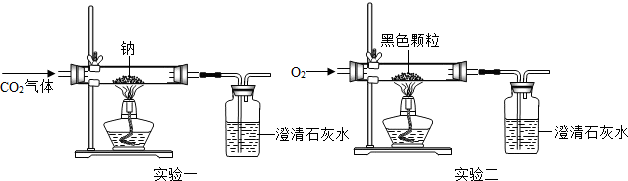
(得出结论) 二氧化碳
(提出问题2)黑色颗粒和白色物质是什么?
(探究活动)探究黑色颗粒的成分
(猜想与假设)同学们猜想黑色颗粒成分可能是
(设计并进行实验二)
实验过程,观察到黑色颗粒逐渐减少,澄清石灰水变浑浊.
(得出结论)实验二证明同学们的猜想是正确的.硬质玻璃管内发生反应的化 学反应式为
[探究活动]探究白色物质的成分
(猜想与假设)同学们对白色物质的成分做出以下猜想:
Ⅰ是碳酸钠;Ⅱ是氢氧化钠.
你认为猜想
通过实验证明,另一猜想正确.反应物中没有氢元素
(得出结论)钠与二氧化碳反应的化学反应式为
查看习题详情和答案>>

(1)上述三个实验的共同点是
①②⑤⑥
①②⑤⑥
(填序号);①都有光或火焰产生 ②都放热 ③生成物都为固体
④都是化合反应 ⑤都是氧化反应 ⑥生成物都是氧化物
(2)硫燃烧实验中水的作用是
吸收有毒的SO2
吸收有毒的SO2
;(3)铁丝燃烧的化学反应式为
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
;
| ||
(4)从化学反应前后氧元素化合价的变化分析,氧气在上述反应中具有氧化性的原因是
氧元素从O价变为-2价
氧元素从O价变为-2价
.(提出问题1)只有氧气才能支持燃烧吗?
(提示:钠是一种银白色金属.)
(设计实验一)向盛有Na的硬质玻璃管中通入纯净、干燥的CO2,当观察到澄清石灰水中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后玻璃管中有黑色颗粒和白色固体生成.

(得出结论) 二氧化碳
能
能
(“能”或“不能”)支持燃烧.(提出问题2)黑色颗粒和白色物质是什么?
(探究活动)探究黑色颗粒的成分
(猜想与假设)同学们猜想黑色颗粒成分可能是
C
C
.(设计并进行实验二)
实验过程,观察到黑色颗粒逐渐减少,澄清石灰水变浑浊.
(得出结论)实验二证明同学们的猜想是正确的.硬质玻璃管内发生反应的化 学反应式为
C+O2
CO2
| ||
C+O2
CO2
.
| ||
[探究活动]探究白色物质的成分
(猜想与假设)同学们对白色物质的成分做出以下猜想:
Ⅰ是碳酸钠;Ⅱ是氢氧化钠.
你认为猜想
Ⅱ
Ⅱ
(填序号)一定是错误的,理由是Na与CO2中不含氢元素
Na与CO2中不含氢元素
.通过实验证明,另一猜想正确.反应物中没有氢元素
(得出结论)钠与二氧化碳反应的化学反应式为
4Na+3CO2
2Na2CO3+C
| ||
4Na+3CO2
2Na2CO3+C
.
| ||