题目内容
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,平衡时,CO的浓度为________。
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900 ℃
D.使用合适的催化剂 E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2 b.体系压强保持不变
c.v正(O2)=v逆(CO2) d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变 f.CO和O2的体积比保持不变
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2. 40 |
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900 ℃
D.使用合适的催化剂 E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2 b.体系压强保持不变
c.v正(O2)=v逆(CO2) d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变 f.CO和O2的体积比保持不变
(1) 1 mol·L-1 。 (2) 吸热 。(3) c 。 (4) be
试题分析:(1)设平衡时,CO的浓度为x,则根据平衡常数可知
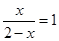 ,解得x=1mol/L。
,解得x=1mol/L。(2)根据表中数据可知,随着温度的升高,K值是增大的,则升高温度,平衡向正反应方向移动,即正反应是吸热反应。
(3)反应①是体积不变的可逆反应,改变压强平衡不移动,A不正确;通入CO2平衡向右移动,但降低了CO2(g)的转化率,B不正确;升高温度到900 ℃,该平衡向右移动且能增大CO2(g)的转化率,C正确;催化剂不能改变平衡状态,D不正确,答案选C。
(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以e正确。A中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此a中的关系始终是成立,不正确。该反应是体积减小但,压强也是减小的,因此当压强不再发生变化时可以说明,所以b正确。c中反应速率的方向相反,但并能满足速率之比是相应的化学计量数之比,c正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,d不正确。CO和O2的体积比保持不变,则是不一定的,答案选be。
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题综合性强,侧重对学生基础知识的巩固和训练,同时注重对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础性知识解决实际问题的能力,也有助于提升学生的学科素养。

练习册系列答案
相关题目

 234U 12O2 13Cl2 14Ar 15Na2O2
234U 12O2 13Cl2 14Ar 15Na2O2