摘要:11.某校化学实验兴趣小组为“证明某水煤气中CO2.CO.H2.H2O(气)共同存在 .经讨论从如下图所示提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰). (1)该小组证明CO2存在应选用 装置.现象是 .证明H2O气的存在应选用 装置.现象是 . (2)若某些仪器可重复使用.某些仪器可不使用.B中反应完全进行.连接的玻璃导管.胶管忽略.按气流从左到右.用上述字母把各装置连接组合起来.正确的连接次序是:混合气体--( ) (3)此实验的操作步骤中还有一欠缺之处.应如何改进? . [解析] 检验H2O(g)的存在时用无水CuSO4.但必须放在装有NaOH溶液的洗气瓶之前.由此可提示我们.要证明各种成分的存在需排除其他物质的干扰.设计实验把干扰物除去才可. [答案] 变浑浊 F 由白色变蓝色 (2)混合气体?F-C-?A?F?C (3)尾气中可能含CO而没有处理.将尾气通过导管引出用酒精灯火焰将CO燃烧掉
网址:http://m.1010jiajiao.com/timu3_id_88031[举报]
 某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”.经讨论从如下图所示提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰).
某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”.经讨论从如下图所示提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰).(1)该小组证明CO2存在应选用
C
C
装置,现象是石灰水)变浑浊
石灰水)变浑浊
.证明H2O气的存在应选用F
F
装置,现象是(无水硫酸铜)由白色变蓝色
(无水硫酸铜)由白色变蓝色
.(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略.按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:
混合气体-
F
F
-C
C
-(B)-A
A
-F
F
-C
C
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?
尾气中可能含CO而没有处理,将尾气通过导管引出用酒精灯火焰将CO燃烧掉
尾气中可能含CO而没有处理,将尾气通过导管引出用酒精灯火焰将CO燃烧掉
.某校化学实验兴趣小组为“证明某水煤气中CO2、CO 、H2 H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其它杂质气体对本实验无干
扰)
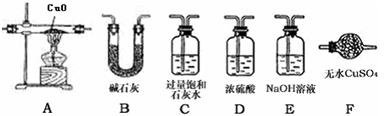
(1)该小组证明CO2存在应选用_▲_装置,现象是:_▲_。 证明H2O气的存在应选用_▲_装置,现象是:_▲_。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B )—( )—( )—( )
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?_▲_。
查看习题详情和答案>>
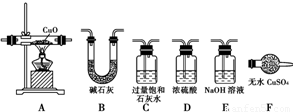
某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”.经讨论从如下图所示提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰).
(1)该小组证明CO2存在应选用______装置,现象是______.证明H2O气的存在应选用______装置,现象是______.
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略.按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:
混合气体-______-______-(B)-______-______-______
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?______.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)该小组证明CO2存在应选用______装置,现象是______.证明H2O气的存在应选用______装置,现象是______.
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略.按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:
混合气体-______-______-(B)-______-______-______
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?______.
 查看习题详情和答案>>
查看习题详情和答案>>
某校化学实验兴趣小组为“证明某水煤气中CO2、CO 、H2 H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其它杂质气体对本实验无干
扰)

(1)该小组证明CO2存在应选用_▲_装置,现象是:_▲_。证明H2O气的存在应选用_▲_装置,现象是:_▲_。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B )—( )—( )—( )
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?_▲_。
扰)

(1)该小组证明CO2存在应选用_▲_装置,现象是:_▲_。证明H2O气的存在应选用_▲_装置,现象是:_▲_。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B )—( )—( )—( )
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?_▲_。
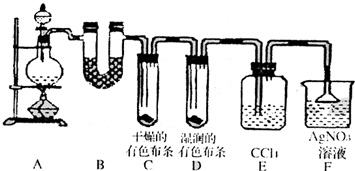 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)下列方法中,可制得氯气的正确组合是
D
D
.①MnO2和浓盐酸混合共热②MnO2、NaCl和浓硫酸混合共热
③次氯酸钠和浓盐酸混合④K2Cr2O7和浓盐酸混合
⑤KClO3和浓盐酸混合共热⑥KMnO4和浓盐酸混合
A.①②⑥;B.②④⑥;C.①④⑥;D.全部可以
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应
加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应
(3)①装置B的作用是
证明有水蒸气产生
证明有水蒸气产生
,现象是白色固体变蓝色
白色固体变蓝色
.②装置C和D出现的不同现象说明的问题是
干燥氯气无漂白性,次氯酸有漂白性
干燥氯气无漂白性,次氯酸有漂白性
.③装置E的作用是
吸收氯气
吸收氯气
.④写出装置F中发生反应的离子方程式
Ag-+Cl-═AgCl↓
Ag-+Cl-═AgCl↓
.(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在
E
E
与F
F
之间(填装置字母序号),装置中应放入湿润的淀粉KI试纸(或湿润的有色布条)
湿润的淀粉KI试纸(或湿润的有色布条)
.