摘要:5.右图所示是气体制取装置.下列能用此装置制取气体并能“随开随用.随关随停 的是 ( ) A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气 C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔 [解析] A项不能用H2SO4与CaCO3反应制CO2.应用HCl.因CaSO4微溶于水.C项MnO2与浓HCl反应制Cl2需加热.D项电石与水的反应过于剧烈.且反应放热. [答案] B
网址:http://m.1010jiajiao.com/timu3_id_87914[举报]
某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有

查看习题详情和答案>>
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为
3Fe+4H2O(g)=Fe3O4+4H2
3Fe+4H2O(g)=Fe3O4+4H2
.(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是
一定有Fe3O4,可能有Fe
一定有Fe3O4,可能有Fe
,若溶液未变红色则说明硬质试管中固体物质的成分是Fe3O4和Fe
Fe3O4和Fe
.(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
(用离子方程式表示).(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有
还原
还原
性.由此可知,实验室中FeSO4溶液要临时配制并加少量铁粉的原因是Fe2+易被空气中的氧气氧化而变质
Fe2+易被空气中的氧气氧化而变质
.
Ⅰ.化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究.甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应.他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快.此时,其他组的同学提出方案如下:
乙组:Cu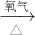 CuO
CuO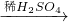 CuSO4
CuSO4
丙组:Cu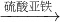 CuSO4
CuSO4
丁组:Cu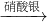 Cu(NO3)2
Cu(NO3)2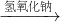 Cu(OH)2
Cu(OH)2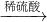 CuSO4
CuSO4
戊组:Cu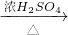 CuSO4
CuSO4
(1)甲组试验可用一个化学反应方程式表示为______;使反应变快的可能原因是______;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的试验操作步骤应为______、______、______,取得产品后的残留物质可循环使用.
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在五组方案中,有科学性错误的是______ 组方案,有污染的是______组方案,无污染但能量消耗较高的是______组方案,因此选择______组方案最好.
Ⅱ.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
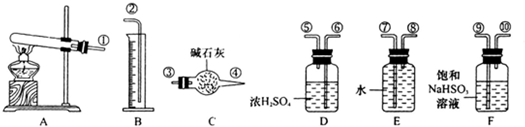
试验测得数据及有关结果如下;
①准确称取6.0g无水CuSO4;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3.按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是______.
(2)装置D的作用是______.
(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温.
②______,
③______.
(4)通过计算,推断出该条件下反应的化学方程式______.
查看习题详情和答案>>
I 化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快。此时,其 他组的同学提出方案如下:

(1)甲组试验可用一个化学反应方程式表示为_______________________;使反应变快的可能原因是_______________________;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的试验操作步骤应为_____________、_____________、______________,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,有科学性错误的是______组方案,有污染的是________组方案,无污染但能量消耗较高的是______组方案,因此选择_______组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,有科学性错误的是______组方案,有污染的是________组方案,无污染但能量消耗较高的是______组方案,因此选择_______组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
 ,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示
,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示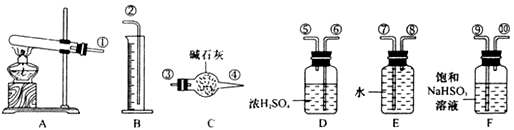
试验测得数据及有关结果如下;
①准确称取6.0g无水CuSO4;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3
按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是_______________________。
(4)装置D的作用是_______________________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。
②_______________________,
③_______________________。
(6)通过 计算,推断出该条件下反应的化学方程式________________。
查看习题详情和答案>>
①准确称取6.0g无水CuSO4;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3
按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是_______________________。
(4)装置D的作用是_______________________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。
②_______________________,
③_______________________。
(6)通过 计算,推断出该条件下反应的化学方程式________________。
I 化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
乙组:
丙组:
丁组:
戊组:
(1)甲组实验可用一个化学反应方程式表示为___________ ;使反应变快的可能原因是__________ ;从该反应器溶液(含有少量 以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,__________ 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
 ,便决定设计实验测定反应生成的
,便决定设计实验测定反应生成的 和O2的物质的量,并经计算确定该条件下
和O2的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
乙组:

丙组:

丁组:

戊组:

(1)甲组实验可用一个化学反应方程式表示为___________ ;使反应变快的可能原因是__________ ;从该反应器溶液(含有少量
 以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。 (2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,__________ 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
 ,便决定设计实验测定反应生成的
,便决定设计实验测定反应生成的 和O2的物质的量,并经计算确定该条件下
和O2的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示: 
试验测得数据及有关结果如下;
① 准确称取6.0g无水;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3按装置从左到右的方向,各仪器接口连结顺序为: ①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是__________。
(4)装置D的作用是__________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。 ②_____________ , ③________________ 。
(6)通过计算,推断出该条件下反应的化学方程式_______________________。
查看习题详情和答案>>
① 准确称取6.0g无水;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3按装置从左到右的方向,各仪器接口连结顺序为: ①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是__________。
(4)装置D的作用是__________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。 ②_____________ , ③________________ 。
(6)通过计算,推断出该条件下反应的化学方程式_______________________。
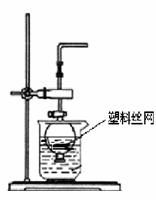
(1)实验是化学研究的基础,下列有关说法中,正确的是_______(填序号字母) 。
a.可在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
b.用pH试纸测定溶液的pH时,不需用蒸馏水润湿试纸
c.实验室中不慎将酒精撒在台面上起火,可用湿抹布覆盖灭火
d.实验室取用少量白磷时,可将白磷取出,在空气中用小刀切割
(2)用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如右图所示。能用此装置制备的气体有 ![]()
![]() (填序号字母)。
(填序号字母)。
a. 用块状大理石与盐酸反应制取CO2
b. 用锌粒与稀硫酸反应制取H2
c. 用过氧化钠与水反应制取O2
d. 用二氧化锰与浓盐酸反应制取Cl2