题目内容
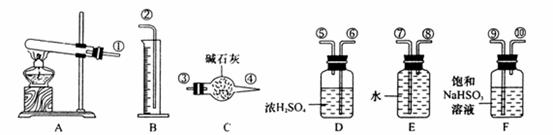
I 化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快。此时,其 他组的同学提出方案如下:
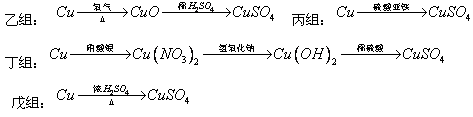
(1)甲组试验可用一个化学反应方程式表示为_______________________;使反应变快的可能原因是_______________________;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的试验操作步骤应为_____________、_____________、______________,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,有科学性错误的是______组方案,有污染的是________组方案,无污染但能量消耗较高的是______组方案,因此选择_______组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,有科学性错误的是______组方案,有污染的是________组方案,无污染但能量消耗较高的是______组方案,因此选择_______组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
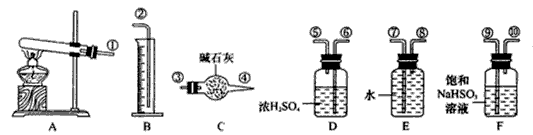
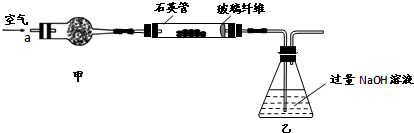
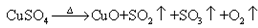 ,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示
,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示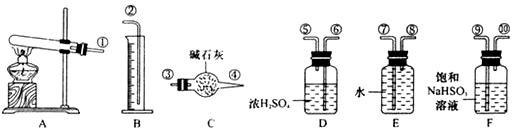
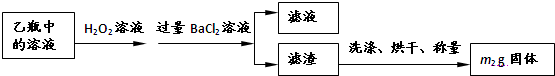
试验测得数据及有关结果如下;
①准确称取6.0g无水CuSO4;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3
按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是_______________________。
(4)装置D的作用是_______________________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。
②_______________________,
③_______________________。
(6)通过 计算,推断出该条件下反应的化学方程式________________。
①准确称取6.0g无水CuSO4;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3
按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是_______________________。
(4)装置D的作用是_______________________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。
②_______________________,
③_______________________。
(6)通过 计算,推断出该条件下反应的化学方程式________________。
(1) 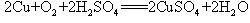 ; 形成了原电池;加热蒸发;冷却结晶;过滤并洗涤晶体。
; 形成了原电池;加热蒸发;冷却结晶;过滤并洗涤晶体。
(2)丙,戊,乙,甲
(3)吸收SO3放出等物质的量的SO2
(4)干燥SO2和O2
(5)②调节量筒使其液面与E装置中的液面持平;③读曲量筒中液体体积时,视线与液体的凹液面相平。(其他合理答案均可)
(6)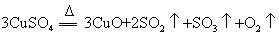
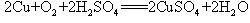 ; 形成了原电池;加热蒸发;冷却结晶;过滤并洗涤晶体。
; 形成了原电池;加热蒸发;冷却结晶;过滤并洗涤晶体。(2)丙,戊,乙,甲
(3)吸收SO3放出等物质的量的SO2
(4)干燥SO2和O2
(5)②调节量筒使其液面与E装置中的液面持平;③读曲量筒中液体体积时,视线与液体的凹液面相平。(其他合理答案均可)
(6)
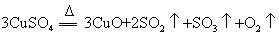

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


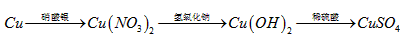

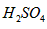 以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。  ,便决定设计实验测定反应生成的
,便决定设计实验测定反应生成的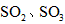 和O2的物质的量,并经计算确定该条件下
和O2的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示: