摘要:16.将锌片和银片浸入稀硫酸中组成原电池.两电极间连接一个电流计. 锌片上发生的电极反应: , 银片上发生的电极反应: . (2)若该电池中两电极的总质量为60 g.工作一段时间后.取出锌片和银片洗净干燥后称重.总质量为47 g.试计算: ①产生氢气的体积, ②通过导线的电量.(已知NA=6.02×1023 mol-1.电子电荷为1.60×10-19 C) [解析] (1)锌-银在稀硫酸中组成原电池.锌比银活泼.锌失去电子作负极.电极反应为Zn―→Zn2++2e-.银作正极.电极反应为2H++2e-―→H2↑. (2)Zn+2H+===Zn2++H2↑.减少的质量就是参加反应锌的质量.故参加反应的锌为60 g-47 g=13 g.用锌来计算生成氢气的体积.通过计算消耗锌转移电子的物质的量.进一步计算通过的电量. [答案] (1)Zn―→Zn2++2e- 2H++2e-―→H2↑ (2)①锌片与银片减少的质量等于生成氢气所消耗的锌的质量.设产生的氢气体积为x.m(Zn)=60 g-47 g=13 g. Zn+2H+===Zn2++H2↑ 65 g 22.4 L 13 g x x=13 g×22.4 L÷65 g=4.48 L ②反应消耗的锌为:13 g÷65 g·mol-1=0.20 mol 1 mol Zn变为Zn2+时.转移2 mol e-.则通过的电量为:
网址:http://m.1010jiajiao.com/timu3_id_87315[举报]
工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡.有关该制备方法的叙述中,不正确的是( )
| A、该方法应用了原电池工作原理 | B、该方法不产生污染大气的二氧化硫 | C、该方法提高了硫酸的利用率 | D、该方法提高了铜的利用率 |
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )

A、d为负极,发生氧化反应
B、c为锌片,电池工作时,溶液中SO42-向c移动
C、电池工作的过程中,d电极上产生大量的气泡
D、电池工作的过程中,溶液中SO42-浓度基本不变
查看习题详情和答案>>
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )
A、d为负极,发生氧化反应
B、c为锌片,电池工作时,溶液中SO42-向c移动
C、电池工作的过程中,d电极上产生大量的气泡
D、电池工作的过程中,溶液中SO42-浓度基本不变
查看习题详情和答案>>
|
下图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极.则下列有关判断正确的是
| |
A. |
d为正极,发生氧化反应 |
B. |
c为铜片,铜片上发生还原反应 |
C. |
电池工作的过程中,d电极上产生大量的气泡 |
D. |
电池工作的过程中,溶液中 |
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )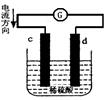
| A.d为负极,发生氧化反应 |
| B.c为锌片,电池工作时,溶液中SO42-向c移动 |
| C.电池工作的过程中,d电极上产生大量的气泡 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
